We translate sequences to science and industry.
Tel: 027-87050299Email: sales@rxbio.cc
We translate sequences to science and industry.
真核生物基因表达受RNA聚合酶、转录因子、组蛋白修饰等调控。表观遗传研究者提出染色质免疫沉淀技术(ChIP)以定位DNA-蛋白质互作区域。随着二代测序技术发展,ChIP与测序结合开发出ChIP-seq技术。以单碱基分辨率匹配转录因子结合足迹,对研究转录因子结合调控机制至关重要。但传统ChIP-seq技术分辨率有限,无法确定具体结合位点。为确定具体结合位点,需预测结合位点并进行单碱基突变,构建大量报告基因载体进行验证,这些方法工作量大、周期长、假阳性高。
美国宾州州立大学帕克分校Frank Pugh教授团队开发了ChIP-exo技术,以单核苷酸分辨率定位全基因组转录因子结合位点。与ChIP-seq比,ChIP-exo需DNA末端修复、加A、连接接头等步骤,降低了DNA回收量。DNA片段需经历2次低效连接以获两端接头,低起始量ChIP DNA在文库制备PCR中易过度扩增,导致不可重复噪音数据。
武汉瑞兴经过自主开发和优化,利用λ-核酸外切酶消化DNA会产生单链DNA(ssDNA),对单链DNA作为模板进行文库构建,就能省去λ-核酸外切酶消化之前需要对DNA进行末端修复、加A、连接接头等反应和漂洗等操作步骤,提高可被回收的DNA 量,提高文库构建成功率和产量。
1) 甲醛交联;
2) 超声打断;
3) 免疫沉淀;
4) 核酸外切酶消化;
5) 提取DNA;
6) 单链DNA建库。
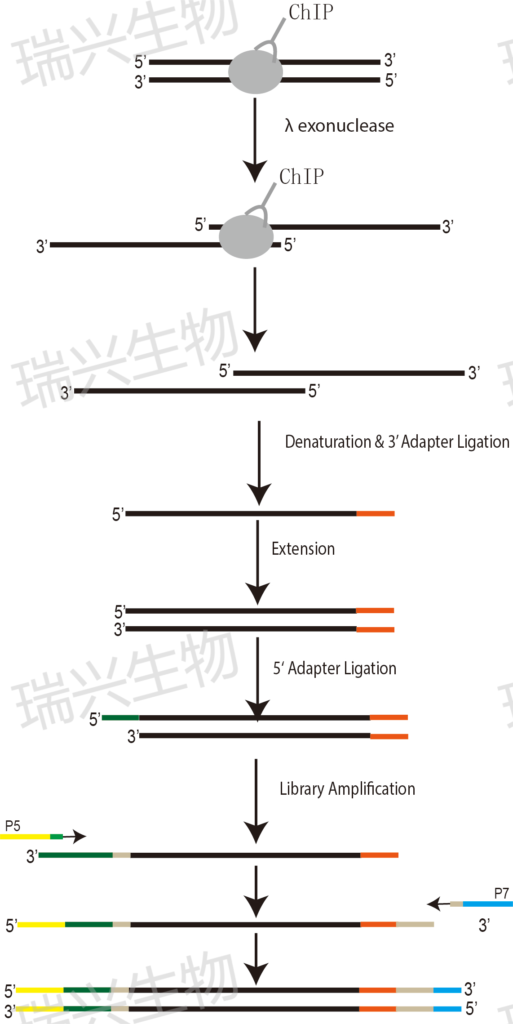
图1 ChIP-exo实验流程图
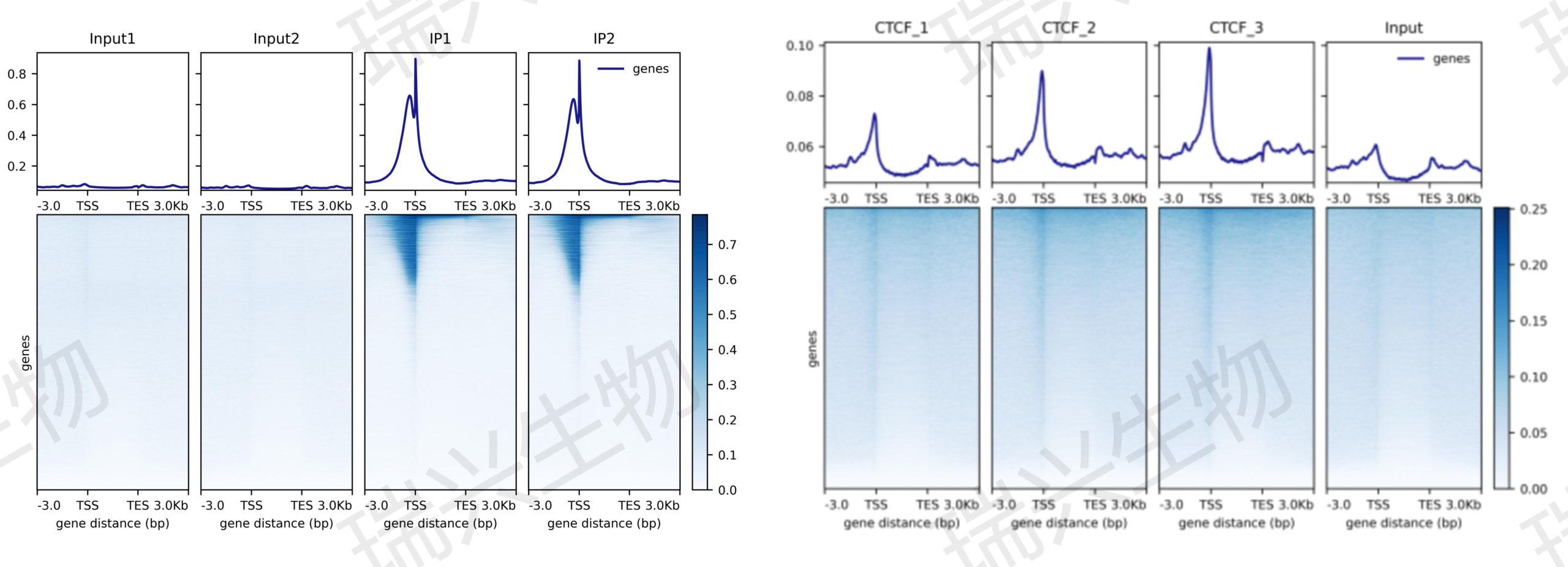 图2.reads在基因组上的分布(左图:H3K4me3;右图:CTCF)
图2.reads在基因组上的分布(左图:H3K4me3;右图:CTCF)
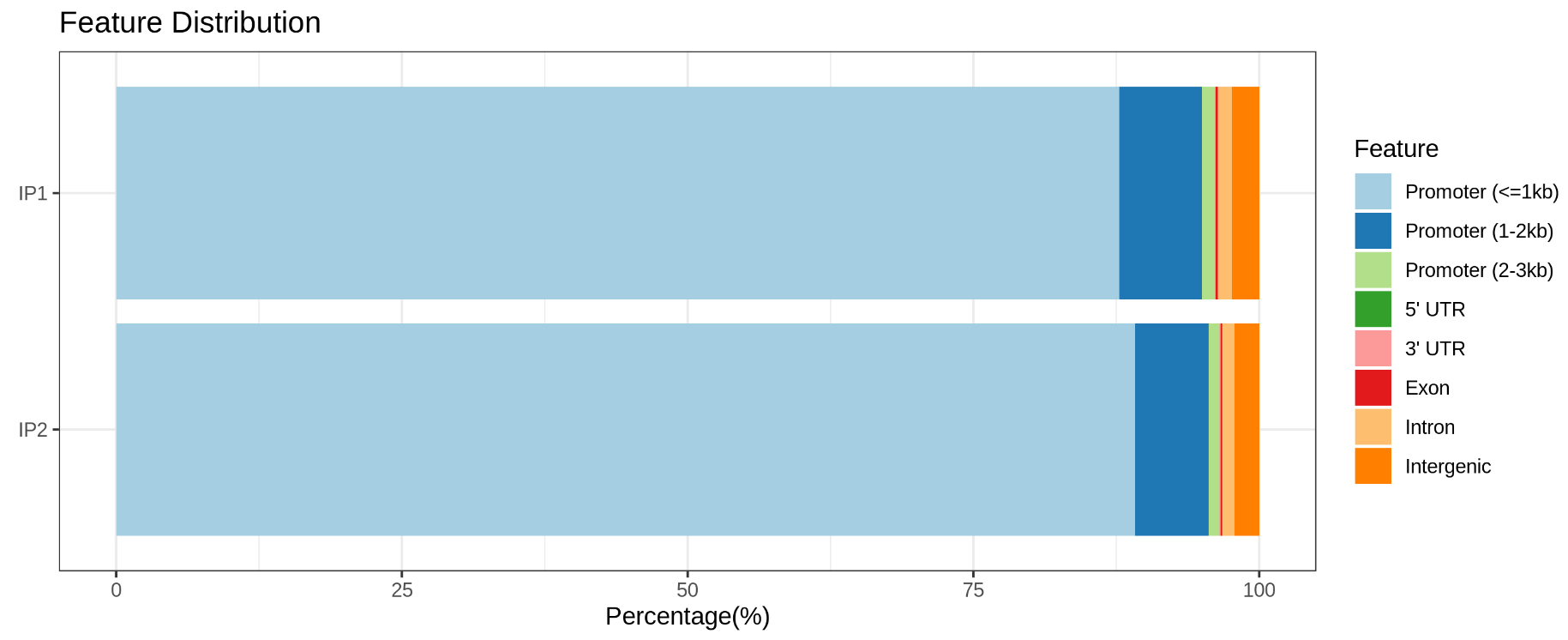
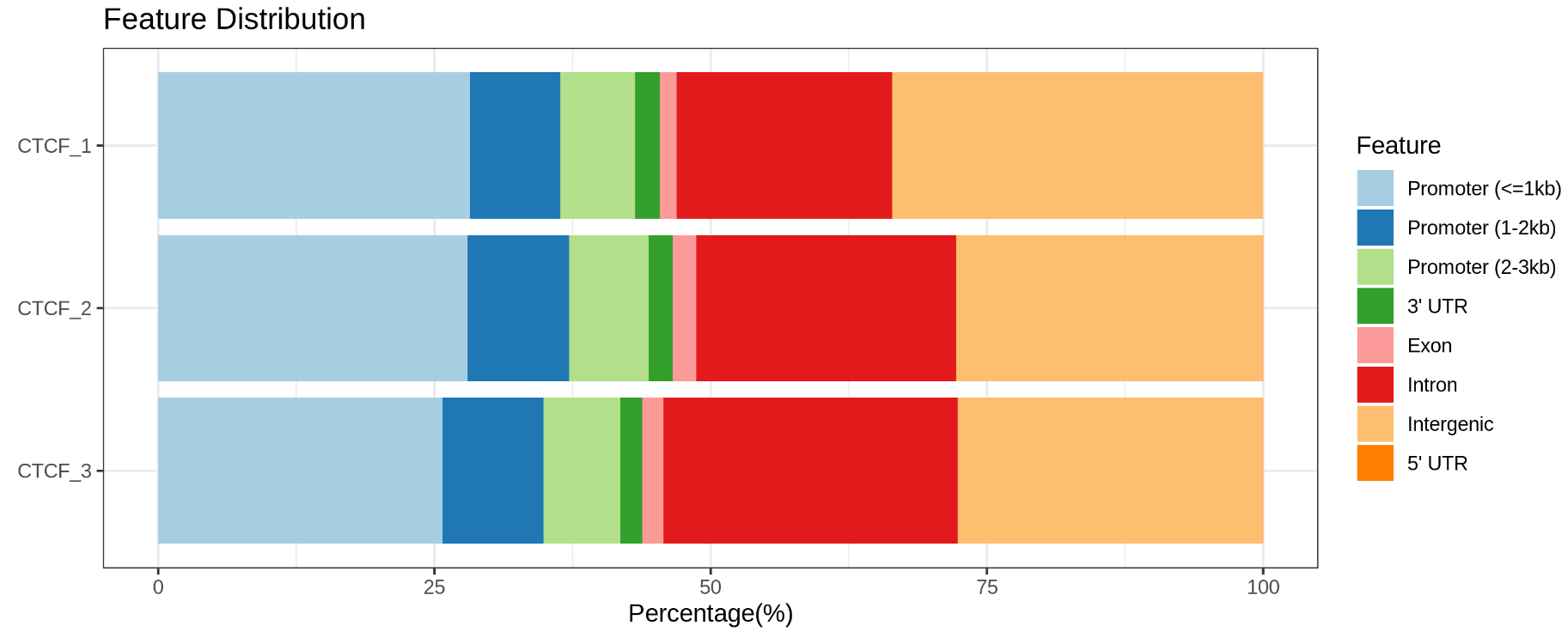 图3.Peak在基因功能区域上的分布(上图:H3K4me3;下图:CTCF)
图3.Peak在基因功能区域上的分布(上图:H3K4me3;下图:CTCF)


在《Nature》杂志上的一篇题为“A high-resolution protein architecture of the budding yeast genome”的文章中的最新研究发现,酵母基因组中400多种不同染色体蛋白质的精确结合位点,其中大部分可调控基因的表达。
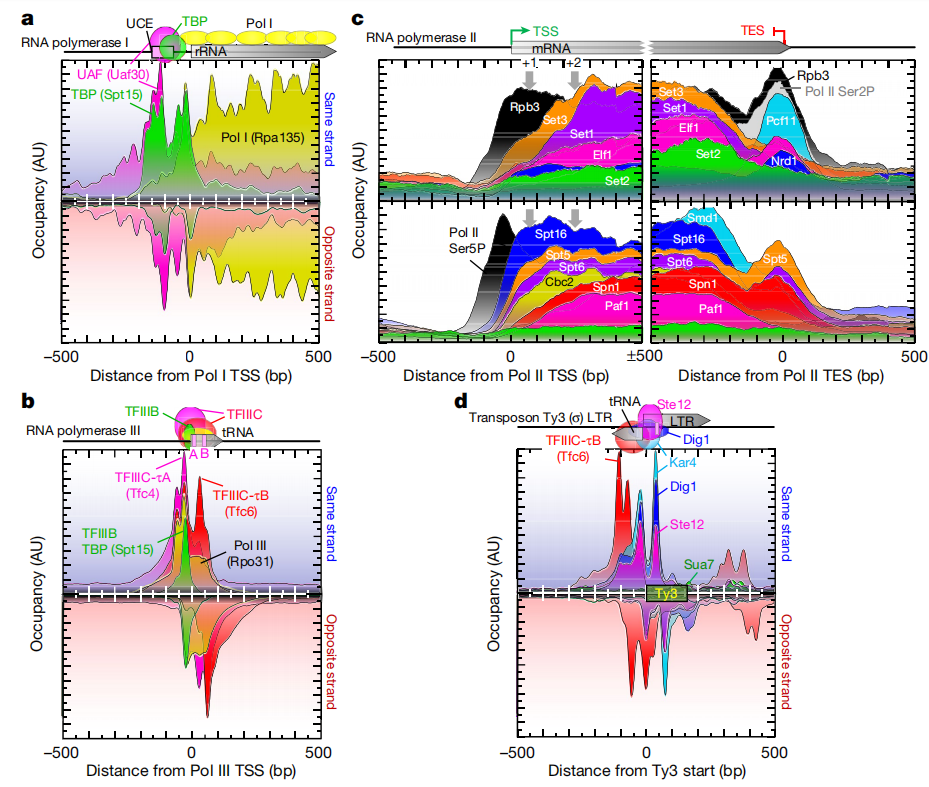
该团队完成了1200多个ChIP-exo实验,生成了数十亿数据点。为分析这些数据,他们借助了宾州州立大学的超级计算集群和自创的生物信息学工具,识别并揭示了酵母基因组中调节蛋白的组织模式。研究发现,酵母基因组中少数独特蛋白质组合被重复使用。
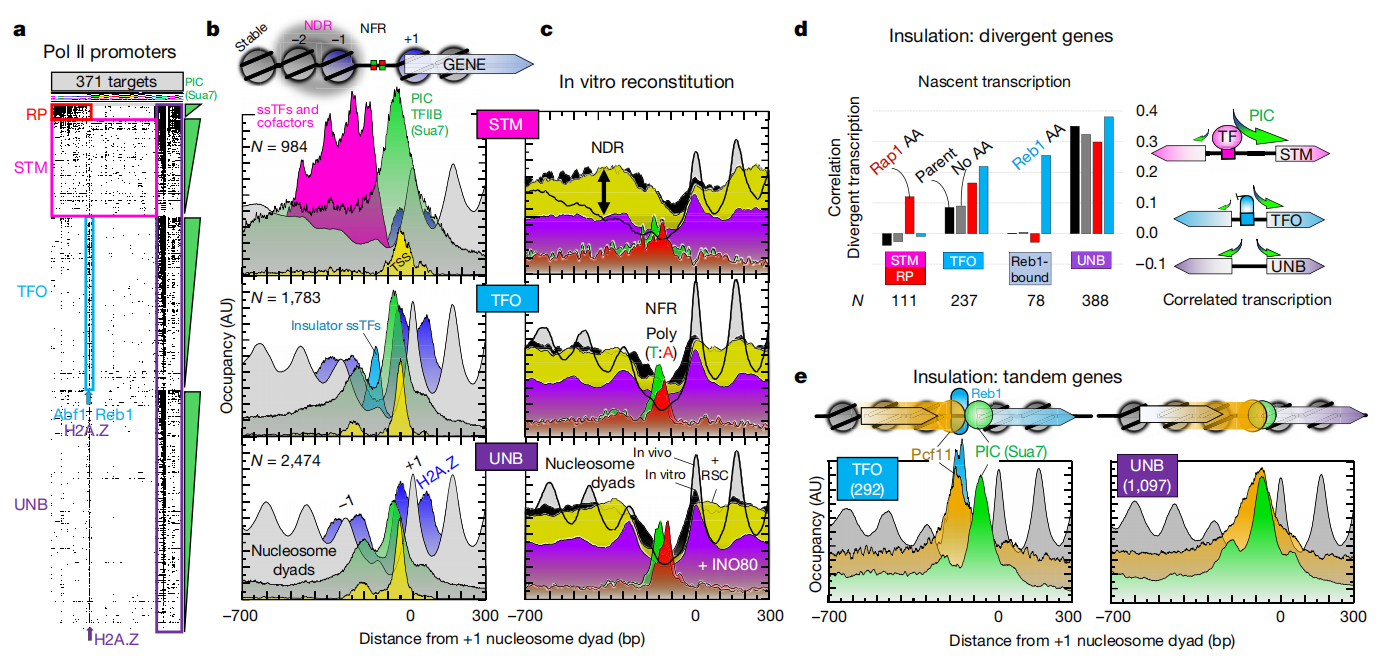
研究人员发现,RNA与TOP1的活性相反,但重要的是,RNA聚合酶II(一种能将DNA转录成为mRNA的多蛋白复合体)能激活转录过程。研究者Mannan Bhola表示,本文研究揭示了一种独特的机制,即RNA能调节TOP1所介导的DNA松弛,从而在调节基因转录过程中扮演重要角色;通过识别出TOP1能作为一种RNA结合蛋白,研究人员就为揭示转录期间RNA和DNA之间的相互作用提供了新的见解。TOP1在很多人类癌症中都会过度表达,从而就能在转录过程中帮助调节DNA的功能,并未开发新型癌症疗法提供一定的信息作者采用ChIP-exo/seq技术,在酿酒酵母中定义了特定结构。我们识别了21个元组合,包含约400种不同蛋白质,与DNA复制、着丝粒、亚着丝粒、转座子及RNA聚合酶(Pol)I、II、III的转录相关。复制蛋白吞噬核小体,着丝粒无核小体,抑制性蛋白在亚端粒X元件处有3个核小体。Pol II相关启动子大多缺乏调控区,仅含核心启动子。这些启动子含与+1核小体相邻的短无核小体区(NFR),与转录起始因子TFIID结合形成预起始复合物。这项研究发现两种不同基因调控结构,扩展了传统模式。组成型基因执行基础功能,需简单调节;诱导型基因对环境信号敏感,结构更复杂。传统模型涉及转录因子结合DNA控制表达。但酵母中大多数“管家”基因缺乏特定蛋白质DNA结构,这是可诱导基因的特点。
参考文献
【1】Rossi, M.J., Lai, W.K.M. & Pugh, B.F. Simplified ChIP-exo assays. Nat Commun 9, 2842 (2018). https://doi.org/10.1038/s41467-018-05265-7.
【2】Rossi, M.J., Kuntala, P.K., Lai, W.K.M. et al. A high-resolution protein architecture of the budding yeast genome. Nature 592, 309–314 (2021).https://doi.org/10.1038/s41586-021-03314-8.