一个长期被忽视的分子机制正逐渐浮出水面:RNA可变剪接(Alternative Splicing, AS)异常。
最近, 发表在《Cell Metabolism》的一项重量级研究揭示了一个全新的分子轴心:转录因子 HNF1A 与 剪接因子 A1CF 协同,构建了β细胞特异性的“转录-剪接调控网络”。当这一轴心在糖尿病中受损时,会导致关键基因的异常剪接,从而直接损害胰岛β细胞的胰岛素分泌功能。

英文题目:HNF1A and A1CF coordinate a beta cell transcription-splicing axis that is disrupted in type 2 diabetes
中文题目:HNF1A与A1CF协同调控β细胞转录-剪接轴,该轴在2型糖尿病中受损
发表时间:2025.8
发表期刊:Cell Metabolism (Q1 IF=30.9)
DOI:10.1016/j.cmet.2025.07.007
为什么关注
可变剪接?
一个基因在不同剪接模式下,可能决定着β细胞是“高效分泌”还是“功能低下”。
AS异常不只是“附属现象”,而可能是疾病发生的直接推手。
一步步揭开
糖尿病的“剪接”之谜
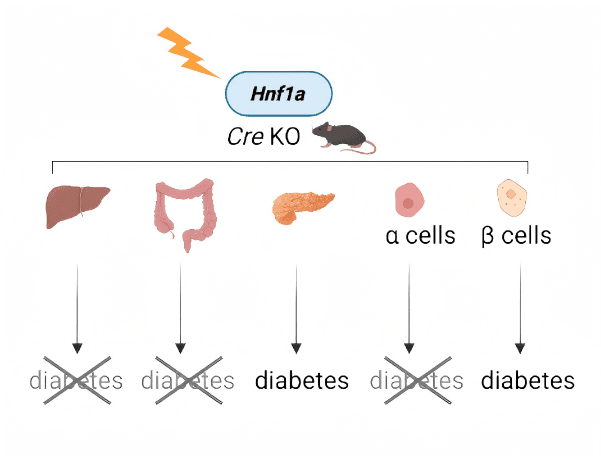
然而,我们并不清楚:HNF1A缺陷到底在哪个细胞环节致病?它如何导致β细胞功能异常?
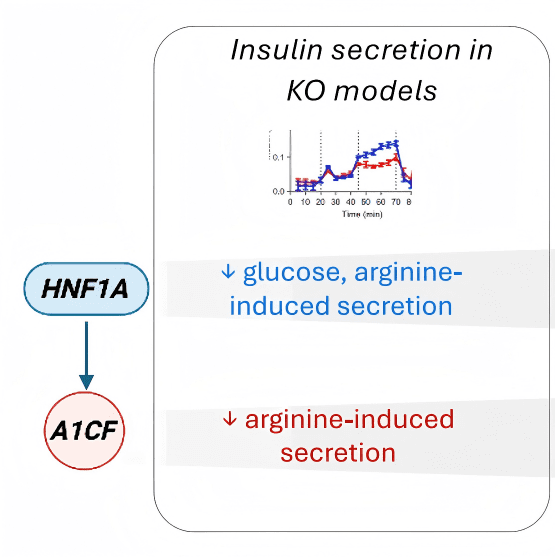
● 仅在β细胞中敲除 Hnf1a → 小鼠立刻出现高血糖、胰岛素分泌缺陷
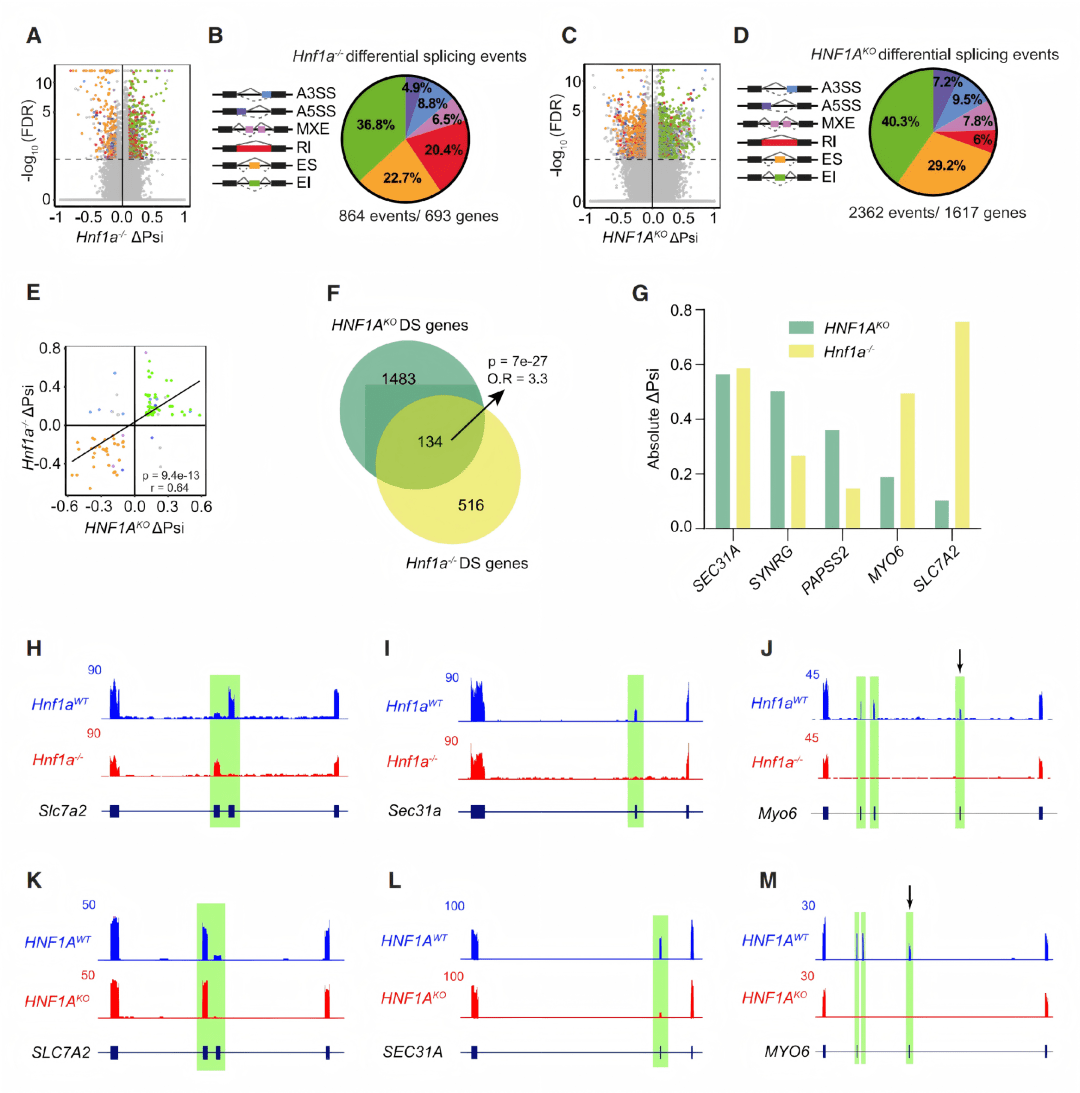
● 在HNF1A缺失模型中,上百个基因转录量下调
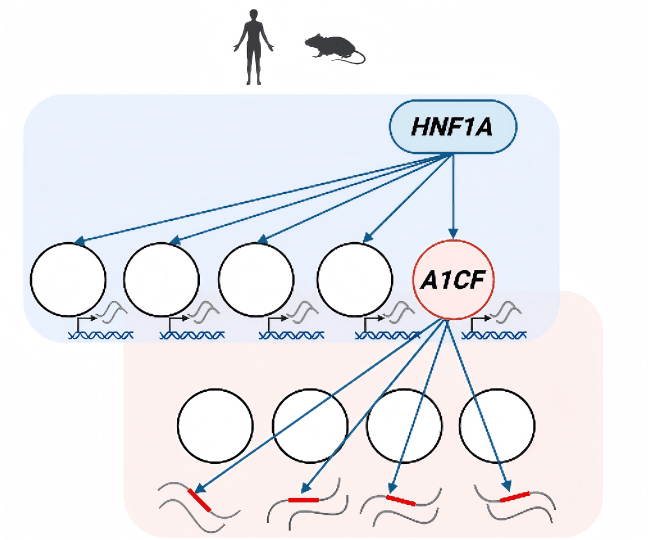
● 这些基因中显著富集了RNA结合蛋白(RBPs),提示转录缺陷可能影响RNA加工过程
● 它是一个RNA结合蛋白,早期被认为主要参与RNA编辑(本研究揭示了它在胰腺β细胞中的全新核心功能——调控可变剪接)
● 在HNF1A缺失时,A1CF表达几乎完全沉默。
● 很多基因的表达量并没有变化,却发生了明显的剪接改变(如关键β细胞功能基因如 SLC7A2, SEC31A, MYO6)
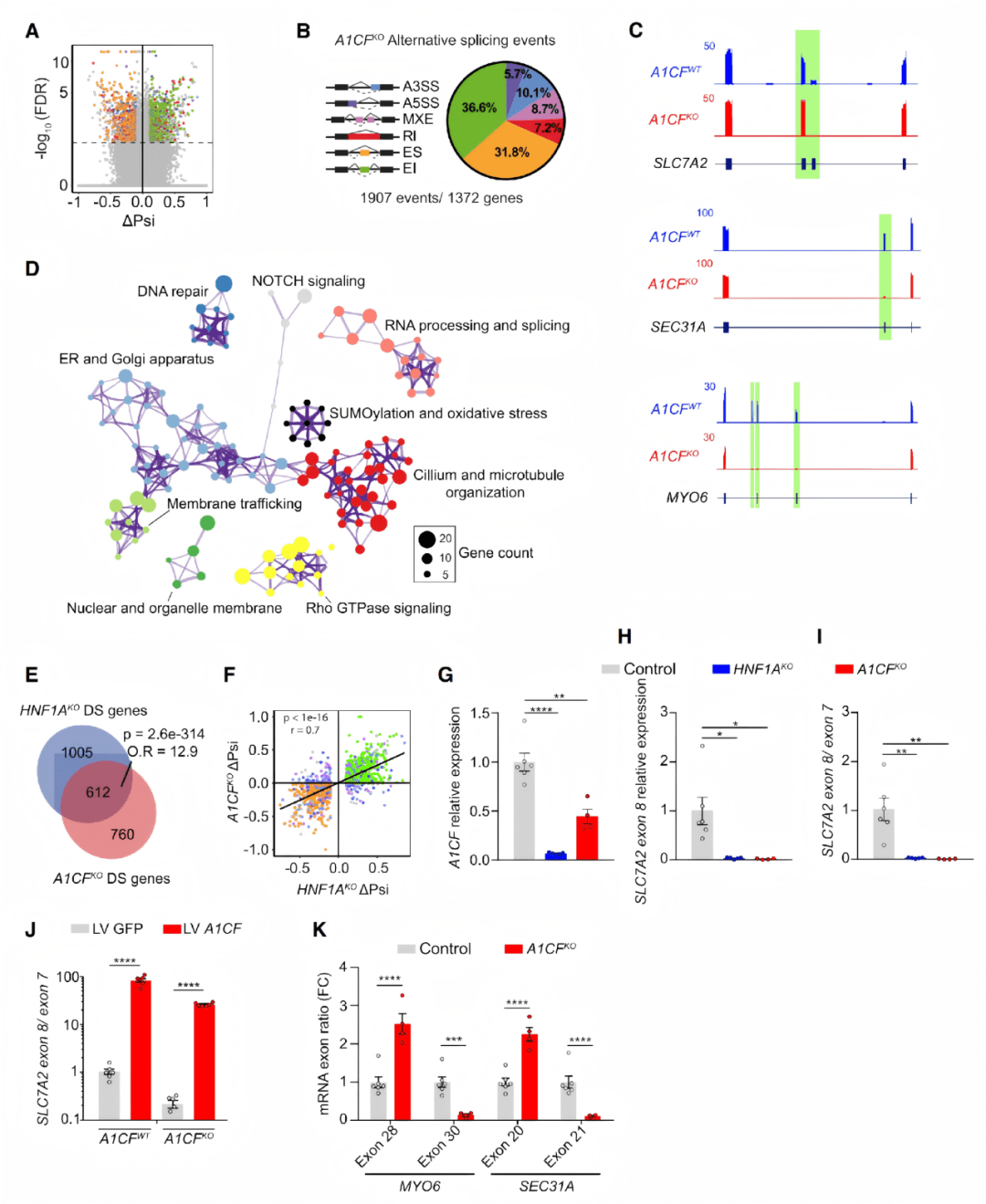
● A1CF缺失后,出现了 1900+ 剪接异常事件,和HNF1A缺失的谱系高度重叠
● 其中约 45%的异常剪接事件在两个模型中一致,剪接模式高度相关
● A1CF回补实验可恢复部分剪接事件(如 SLC7A2 外显子8)
● HNF1A缺陷模型中同样出现精氨酸反应性降低
● 在成年小鼠中,β细胞特异性敲除 Hnf1a 导致精氨酸诱导的电活动缺失
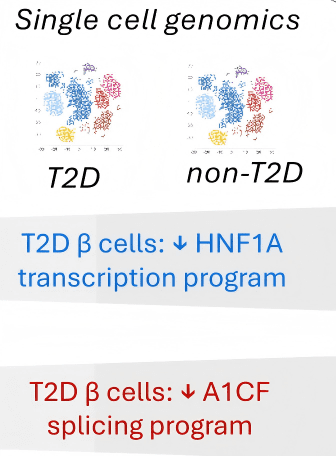
● 在T2D患者中,β2型细胞比例显著升高;
● β2细胞的剪接模式与A1CF KO模型相似(如 SLC7A2 外显子8表达降低)
● 那些提高A1CF表达的等位基因 → 更低血糖、更低糖尿病风险;
● 那些降低A1CF表达的等位基因 → 高血糖、高风险

启发与解决方案
三代全长转录组测序: 解决二代短读长测序的根本性难题——无需拼接,即可直接获得完整、无误的转录本全长序列。精准解析全长异构体,从海量数据中挖掘像A1CF这样的关键RBP和像SLC7A2外显子8跳跃这样的核心剪接事件。
单细胞三代全长转录组: 目前剪接研究领域的终极解决方案,能在单细胞水平上同时分析细胞亚群状态和其特有的全长转录本异构体,直接看到特定细胞亚群的剪接异常。
RBP功能研究 : 我们提供eCLIP-seq、iRIP-seq等技术,精准鉴定RBP在基因组上的直接RNA结合靶点。
Minigene实验:验证特定剪接事件是否直接受某个RBP或顺式元件调控的“黄金标准”。我们将您感兴趣的外显子及其侧翼内含子序列克隆至报告载体中,通过共转染RBP(如A1CF)或突变关键序列,即可在细胞模型中直接、高效地观察该外显子的剪接选择变化,为机制研究提供最直接的证据。
数据整合分析:整合多组学数据、TCGA/GEO/GWAS等公共数据,挖掘核心机制,提供可靠验证。
Bernardo E, De Vas MG, Balboa D, et al. HNF1A and A1CF coordinate a beta cell transcription-splicing axis that is disrupted in type 2 diabetes. Cell Metab. 2025;37(9):1870-1889.e10. doi:10.1016/j.cmet.2025.07.00
