短读长的盲区:你可能错过了大半故事
❌无法判断 基因有哪些异构体(Isoform)
❌ 无法识别 关键的外显子跳跃或保留
❌无法确定 转录起始位点(TSS)和polyA位点(PAS)
❌难以发现 融合基因等结构变异
这些被忽略的结构信息,恰恰是精准医疗与疾病机制研究的关键所在。
三代全长测序:单细胞水平“阅读整本书”
🔍一览无余的转录本结构
• 直接解析转录本结构、精确鉴定剪接事件
• 精准定位TSS与PAS,间接揭示启动子选择与调控的多样性
• 发现大量未被注释的新异构体
🔍 直接捕获临床“犯罪证据”
• 融合基因、肿瘤特异性剪接
• 影响免疫治疗的表位缺失
• 等位基因特异性表达事件
🔍 解析前所未有的细胞异质性
• 在已知的细胞类型中,发现由异构体使用差异定义的全新功能亚群。
创新发现:从“知道有”到“看清是什么”
1 发现“隐形”的细胞亚型

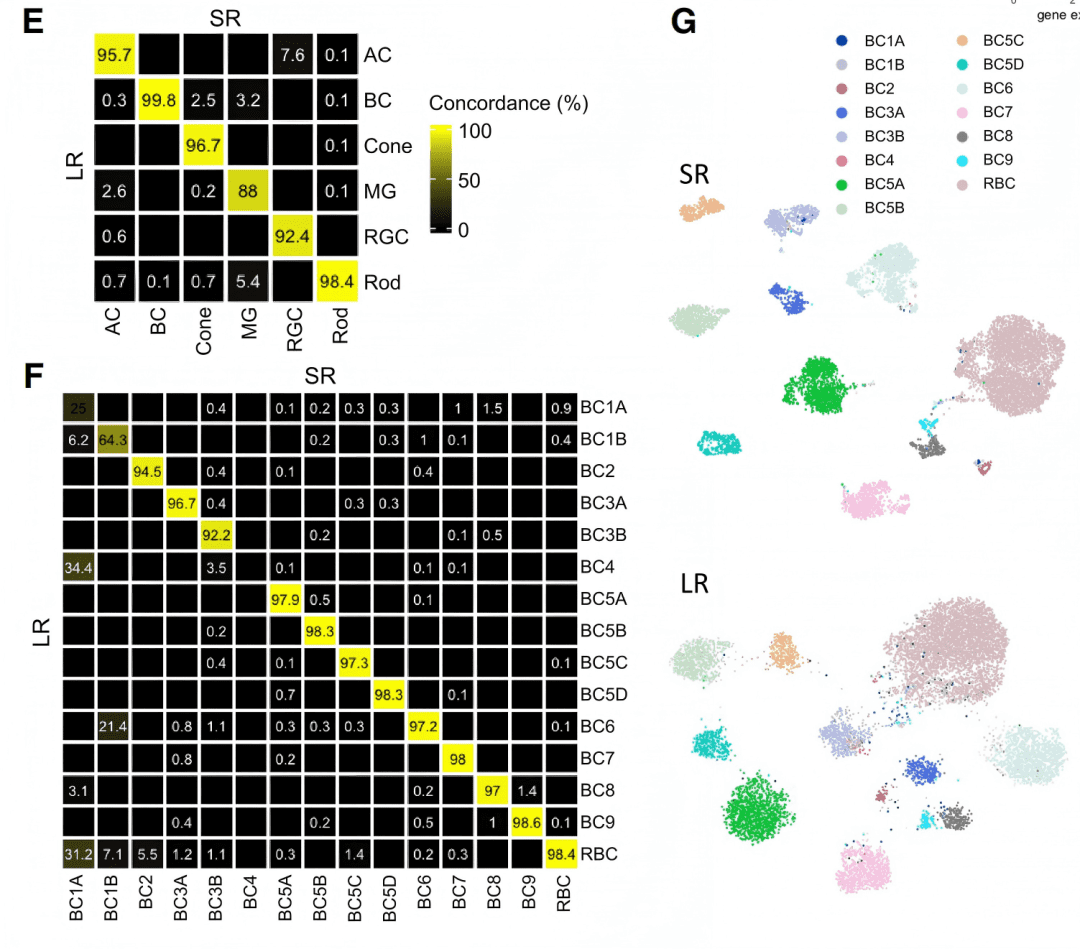
✔ 这为什么重要? 在高度异质性的组织(如神经、肿瘤)中,基于全长转录本的解析能力,能发现真正具有功能特异性的细胞亚群,为靶向治疗提供新线索。
2 解码“沉默”的异构体与细胞特异性剪接

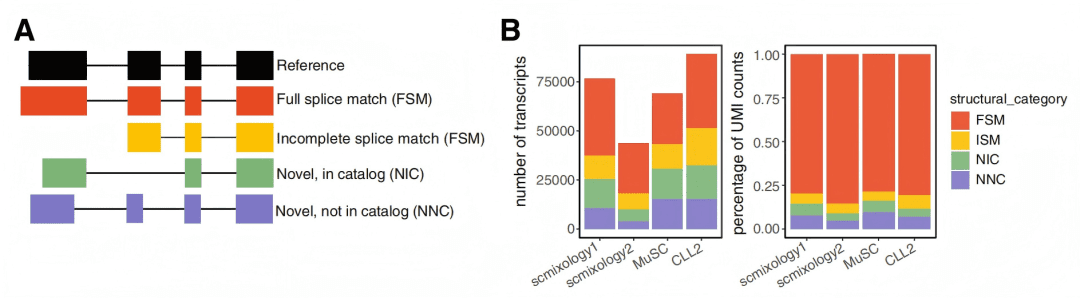
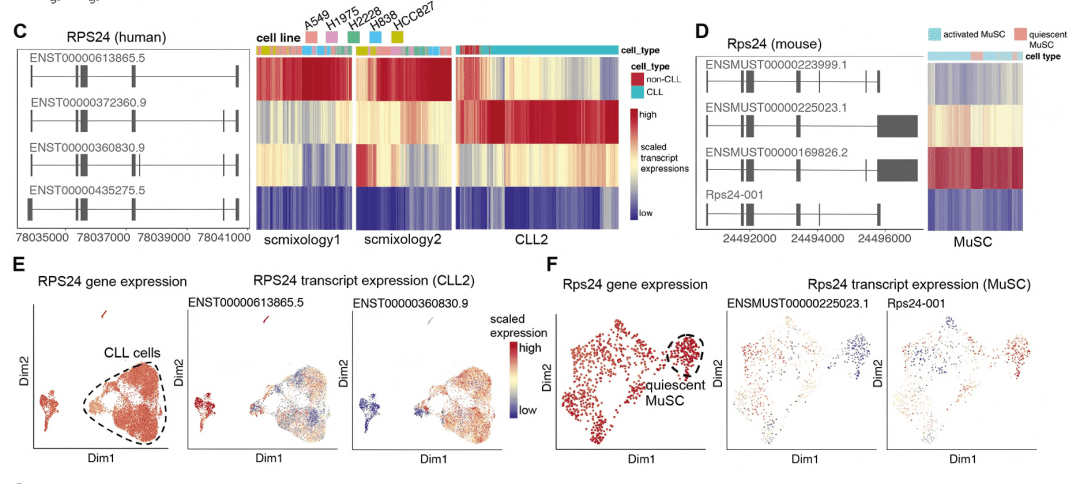
✔ 这为什么重要? 直接揭示了细胞功能多样性的核心调控层,为理解细胞身份和状态转换提供了异构体层面的直接证据。
3 绘制动态的“剪接时钟”


可变剪接的动态变化,能够像“分子时钟”一样,极其精准地指示心脏所处的发育阶段,而基因表达则更多地用于区分细胞类型。
✔ 这为什么重要? 揭示了超越基因表达的、一层全新的发育调控维度,为理解器官成熟与再生提供了新范式。
4 精准鉴定融合基因
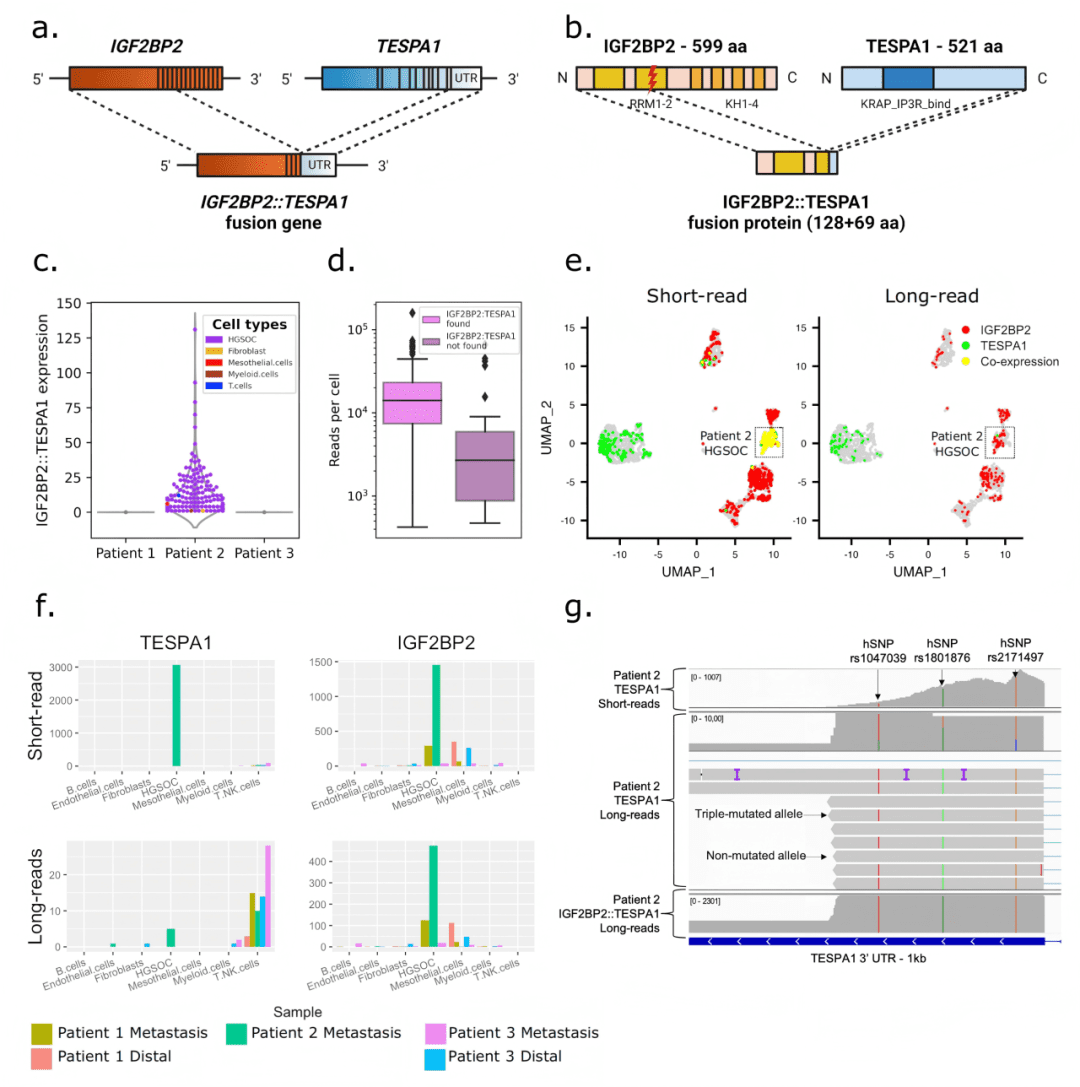
而匹配的短读长数据中,TESPA1基因被错误地报告为高表达——因为大多数测序片段实际来自融合转录本。
✔ 这为什么重要? 全长测序能直接、无误地鉴定融合基因,避免短读长推断带来的误判,为癌症 biomarker 发现与用药靶点确定提供可靠依据。
✅ 可变剪接与异构体功能
✅ 癌症中的融合基因与异常剪接
✅ 免疫受体多样性(BCR/TCR)
✅ 神经科学、发育生物学的转录调控
✅ 等位基因特异性表达
✅ 新基因/新外显子的发现
