01 更深入地了解细胞类型和状态


这对研究有何好处:
空间转录组让您看到更多的基因,从而为您提供更多数据点来识别细胞类型/状态及其在组织中的定位。这可以作为您研究的终点,通过阐明组织的潜在生物学特性,或者帮助您选择更好的标志物补充以进行更有针对性的蛋白质组学研究。
02 通过检查空间关系实现生物标志物的新维度
最近一项研究检查了未免疫和免疫的阿尔茨海默病患者的淀粉样蛋白清除率。在两组中,当观察淀粉样斑块 >20 μm 的细胞时,细胞组成基本相似。当观察来自斑块 <20 μm 的细胞时,未免疫的细胞组成基本保持不变,但免疫患者的髓系细胞急剧增加(>50% 的总细胞),这凸显了空间定位在检查药物反应时的重要性。
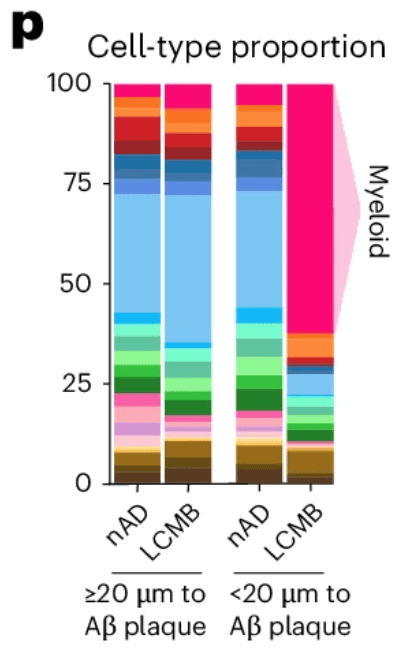
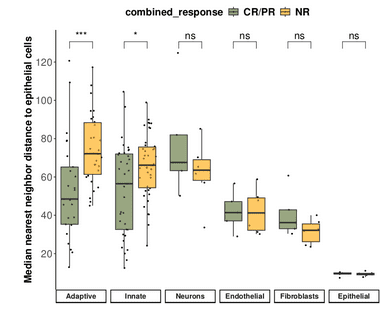
空间转录组通过实现特定细胞和/或现象的空间定位,为您的生物标志物研究增加了另一个维度,从珍贵的样本中为您提供更多信息,并让您看到传统和单细胞测序方法无法获得的信息。
03 更深入地表征细胞的连接和通信方式
虽然传统方法允许检测标记物进行邻域和配体-受体分析,但空间转录组通过添加数量级的标记物来帮助扩展这一点。
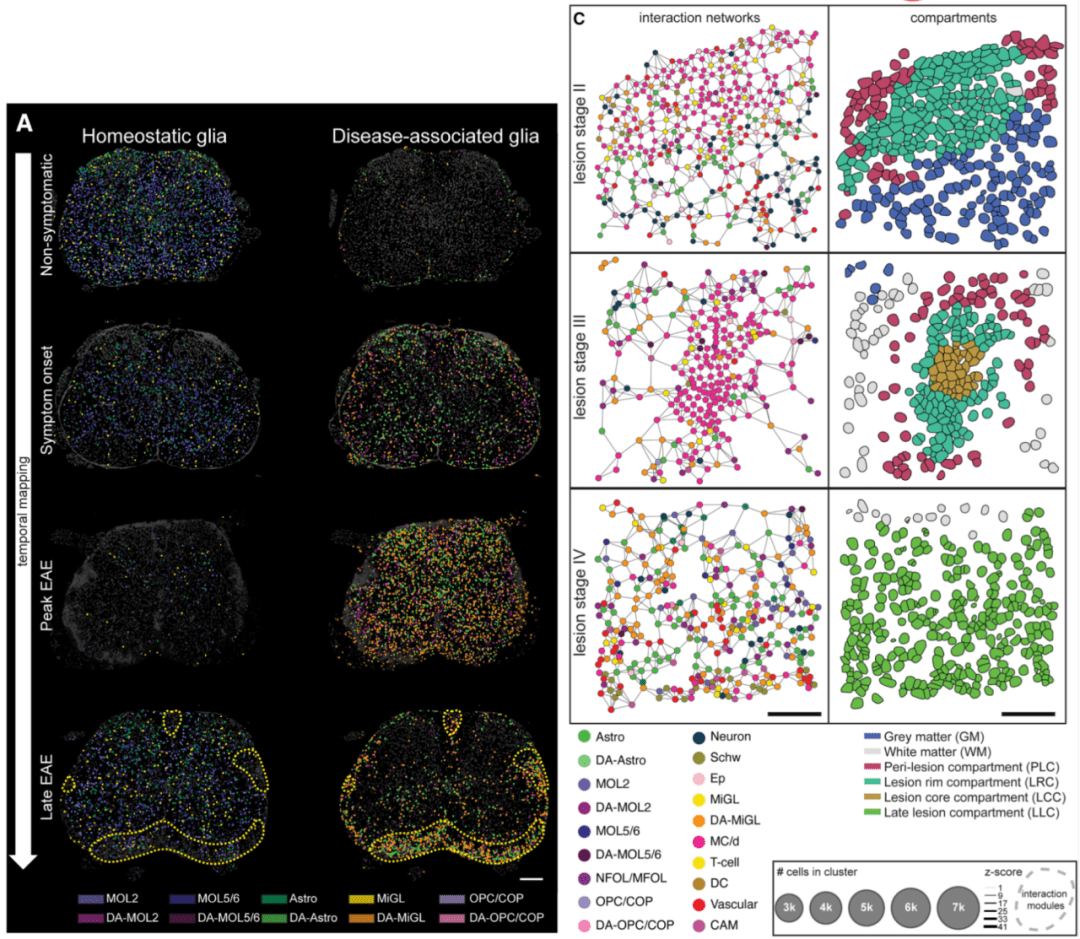
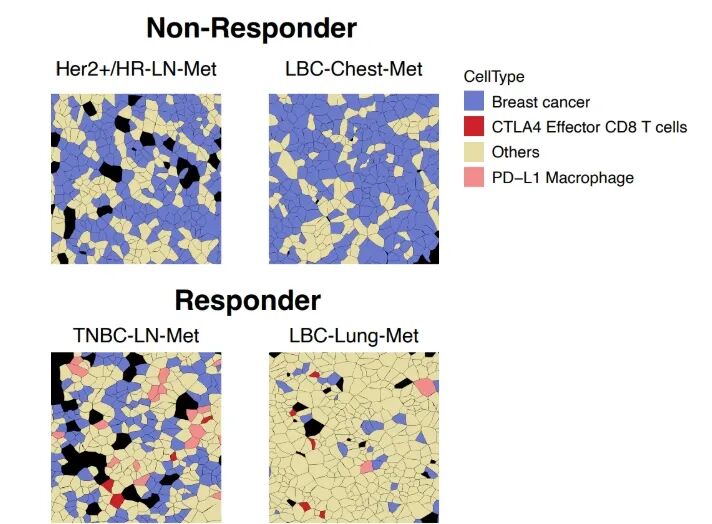
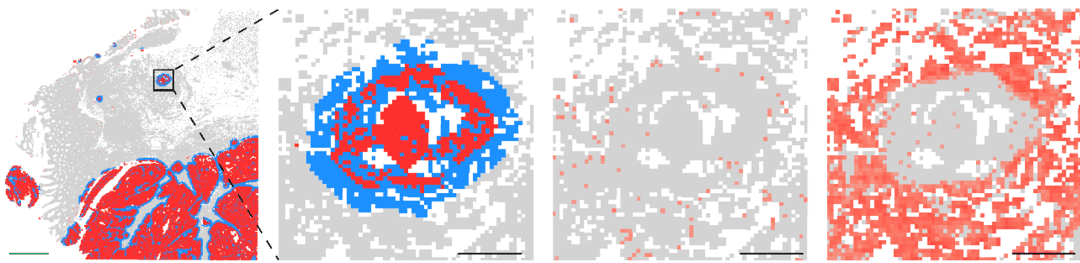
深入表征细胞类型,并观察它们如何与其他细胞共定位,使空间转录组学能够让您更广泛、更深入地了解细胞间通讯,并更好地了解组织微环境和细胞邻域。
[2] Haga Y, et al. Whole-genome sequencing reveals the molecular implications of the stepwise progression of lung adenocarcinoma. Nat Commun (2023). doi: 10.1038/s41467-023-43732-y
[3] Kukanja P, et al. Cellular architecture of evolving neuroinflammatory lesions and multiple sclerosis pathology. Cell (2024). doi: 10.1016/j.cell.2024.02.030
[4] Wang N, et al. Spatial single-cell transcriptomic analysis in breast cancer reveals potential biomarkers for PD1 blockade therapy. Research Square (preprint) (2024). doi: 10.21203/rs.3.rs-4376986/v2
[5] van Ost L et al. Microglial mechanisms drive amyloid-β clearance in immunized patients with Alzheimer’s disease. Nat Med (2025). doi: 10.1038/s41591-025-03664-0
[6] Grande E, et al. Spatial biomarkers of response to neoadjuvant therapy in muscle-invasive bladder cancer: the DUTRENEO trial. medRxiv (2025). doi: 10.1101/2025.02.07.25321742
