01
RBPs核心功能
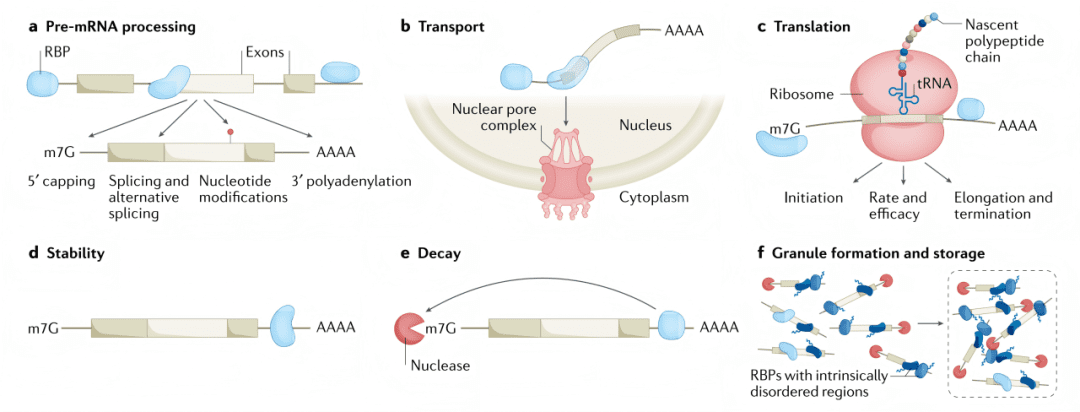
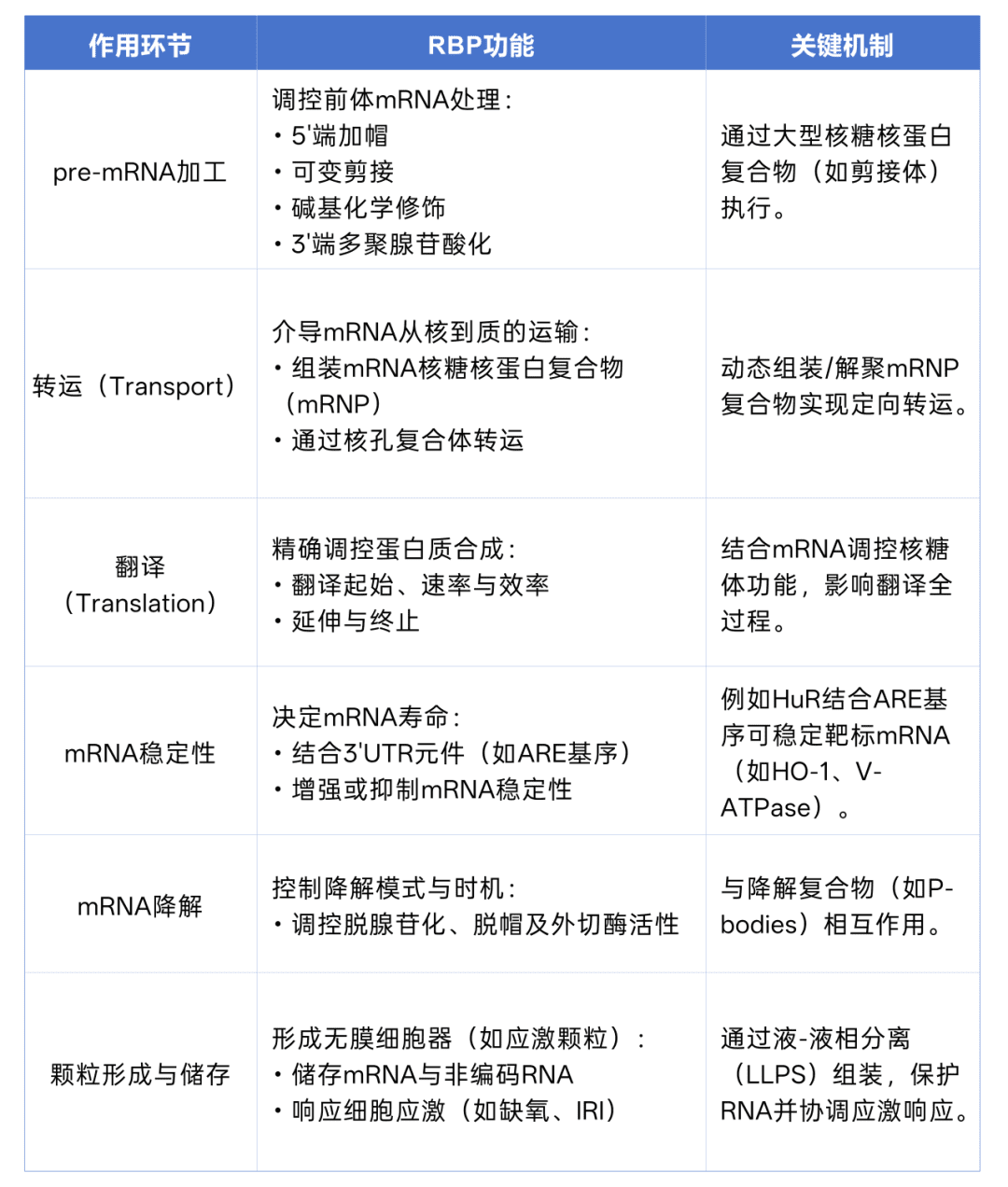
02
RBPs研究方向
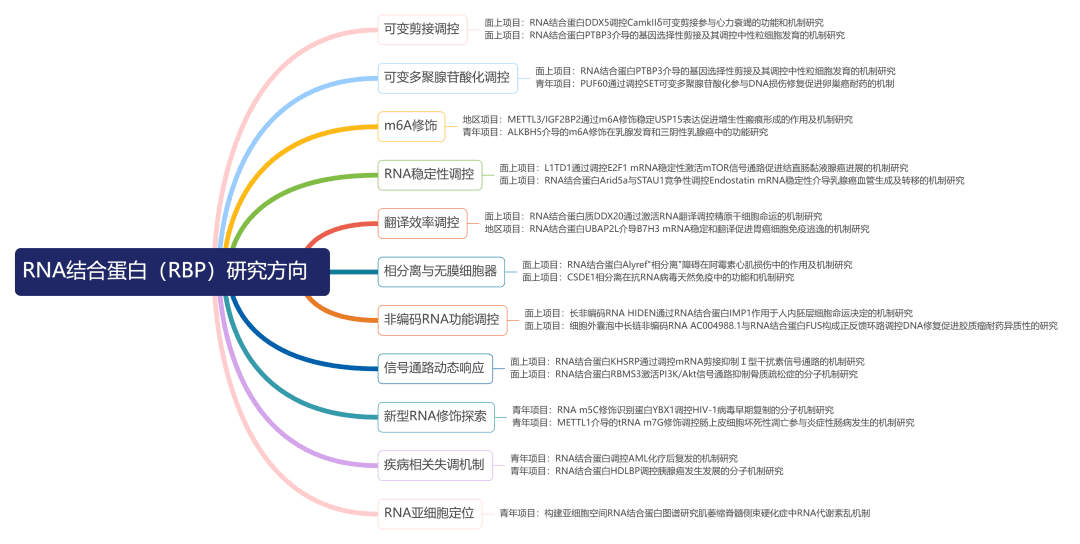
03
RBPs相关技术
• 特点:分辨率不高(RNA片段较长),直接和间接结合的RNA。
• 特点:分辨率提升(RNA酶切片段化),建库方法可实现单碱基分辨率(分析UV交联位点),直接和间接结合的RNA。
• 特点:首次提出Input阴性对照样本,首次不用同位素检测,分辨率提升(RNA酶切片段化),建库方法可实现单碱基分辨率(分析UV交联位点)。主要是直接结合的RNA。
• 特点:体外RNA下拉技术,能够特异性地获得一个RNA(包括lncRNA,circRNA,miRNA,mRNA特定转录本等)的互作蛋白,实验操作流程简单,成功率高。
04
RBPs合作案例

FOXN3是一种转录抑制因子,SIN3A是ER+细胞中的一种抑制因子复合物,本文作者通过研究FOXN3的病理学功能机制,发现FOXN3这种转录因子与SIN3A会发生蛋白质之间的互相作用,并且这种互作需要由乳腺癌细胞中的雌激素诱导产生的NEAT1(一种lncRNA)的参与。

我们报告了自闭症和相关神经发育障碍患者中CSDE1(编码高度受限的RNA结合蛋白)中杂合子,可能是基因破坏变异的显著负担。对 17 名患者的分析确定了常见的表型,包括自闭症、智力障碍、语言和运动迟缓、癫痫发作、巨头畸形和可变眼部异常。HITS-CLIP揭示了Csde1结合靶点在自闭症相关基因集中富集,特别是FMRP靶标,以及神经元发育和突触可塑性相关途径。我们的研究定义了一种新的自闭症相关综合征,并强调了CSDE1在突触发育和突触传递中的功能作用。

论文揭示了多种嗜神经病毒能够在神经元中诱导表达长链非编码RNA EDAL (lncRNA EDAL),通过调控宿主组蛋白甲基转移酶EZH2的降解来促进抗病毒多肽PCP4L1表达从而抑制病毒增殖的分子机制,为进一步研究嗜神经病毒与宿主相互作用的机制提供了新思路。

该研究证明我们证明了癌症转移相关抗原1 (MTA1),一种著名的致癌染色质修饰剂,广泛地与rbp相互作用并共同表达,促进了癌症有丝分裂相关AS。利用开发的fCLIP-seq技术,我们表明MTA1结合丰富的转录本,优先于剪接相关的基序,影响目标转录本的丰度和AS模式。

分子研究表明,IGF2BP2 通过m6A依赖方式。此外STAT6高迁移基团 AT-hook 2-IGF2BP2-过氧化物酶体增殖物激活受体γ轴参与 M2 巨噬细胞分化。这些发现强调了 IGF2BP2 在调节巨噬细胞活化中的关键作用,并暗示了巨噬细胞在炎症性疾病中的潜在治疗靶点。

本研究发现 IGF2BP2 在 T-ALL 中高表达。过表达和敲低IGF2BP2的相关实验表明IGF2BP2促进体外T-ALL细胞增殖,且IGF2BP2的缺失延长了人类T-ALL异种移植模型中的动物存活率。在机制层面,IGF2BP2 通过 m6A依赖的方式,直接结合T-ALL 癌基因 NOTCH1。此外,研究鉴定了一种小分子IGF2BP2抑制剂JX5,用JX5治疗T-ALL显示出与敲低IGF2BP2相似的功能。

在这项工作中,对CRLM,原代CRC和正常组织中lncRNA表达动力学的研究导致鉴定了一系列与转移相关的lncRNA,包括CRLM1。CRLM1抑制CRC细胞凋亡,促进Balb/C裸鼠肝转移。CRLM1与参与细胞粘附和DNA损伤的基因染色质区域弱相关,并且这种关联与CRLM1调控的促转移基因表达双向相关。CRLM1与hnRNPK蛋白发生物理相互作用并促进其核定位。CRLM1有效增强hnRNPK启动子占有率并共同调节一组转移基因的表达。

剪接因子Y盒结合蛋白1(YBX1)在BMSCs中的表达随着衰老而降低。YBX1缺乏导致与BMSC成骨分化和衰老相关的基因(如Fn1,Nrp2,Sirt2,Sp7和Spp1)的错误剪接,从而有助于BMSC衰老和衰老过程中的分化转移。BMSC中Ybx1的缺失加速了小鼠的骨质流失,而其过表达刺激了骨形成。我们的研究表明,YBX1通过精细控制RNA剪接来控制BMSC的细胞命运,并为年龄相关性骨质疏松症提供潜在的治疗靶点。

胆管癌(CCA)预后不良,研究系统探究了依赖 CCA 的 RPS6 基因作用,发现其在 CCA 组织中上调与不良预后相关,能影响 CCA 细胞增殖、致瘤性,还通过多种分析明确其下游信号通路、相关蛋白及对选择性剪接的影响,且靶向 RPS6 的 V-PMO 可抑制 CCA 生长,RPS6 是致癌调节因子,RPS6-V-PMO 有望用于治疗 CCA。
IF 14.9
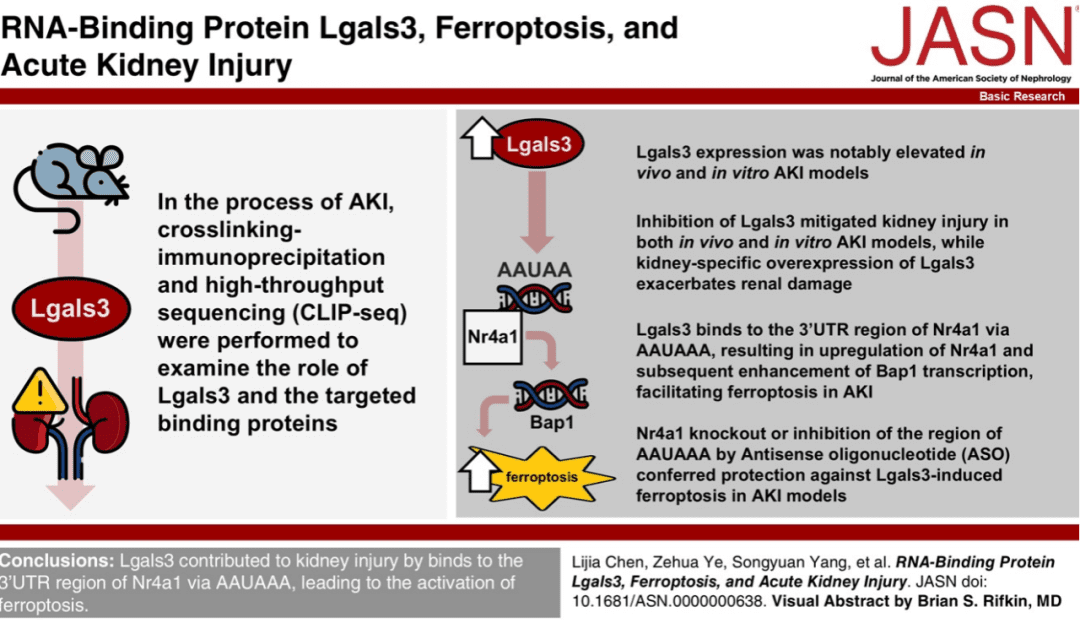
Lgals3 表达在体内和体外 AKI 模型中显著升高。Lgals3 的抑制减轻了体内和体外 AKI 模型中的肾损伤。从机制上讲,Lgals3 通过 AAUAAA 与 Nr4a1 的 3′-非翻译区结合,导致 Nr4a1 上调,随后增强 Bap1 转录,促进 AKI 中的铁死亡。此外,在 AKI 模型中,敲除 Nr4a1 或反义寡核苷酸抑制 AAUAAA 区域可保护 Lgals3 诱导的铁死亡。
