由屠呦呦团队及其合作者在《The Innovation》上发表的最新研究,利用单细胞转录组测序,首次从多组织层面系统揭示了青蒿素在疟疾治疗中一个全新的核心作用——免疫调节。
研究团队构建了高精度的小鼠多组织免疫细胞图谱,精准锁定 CD8+GZMB+ T细胞 是驱动疟疾肝损伤的关键致病亚群。而青蒿素的卓越功效,不仅在于清剿病原,更在于它能如同一把“分子手术刀”,通过抑制JAK2-STAT3信号通路,精准削弱该细胞的毒性,从而缓解免疫病理损伤。
如果您关注感染免疫、药物机理或转化医学,这篇单细胞文献不容错过。
中文题目: 单细胞测序揭示青蒿素通过JAK2-STAT3通路调控疟疾感染小鼠CD8+GZMB+ T细胞的免疫调节作用
发表期刊: The Innovation(Q1,IF=25. 7)
发表时间: 2025.9
DOI: 10.1016/j.xinn.2025.101080
研究背景
疟疾是由疟原虫引起的全球性传染病,其病理不仅源于寄生虫直接破坏,更与宿主过度免疫反应相关。感染可引发全身性炎症,导致肝、脑等重要器官损伤,其中T细胞、单核/巨噬细胞、中性粒细胞等介导的免疫反应在病理过程中起关键作用。
青蒿素的免疫调节作用
青蒿素及其衍生物(如青蒿琥酯)是当前疟疾治疗的核心药物。除直接杀灭疟原虫外,研究显示其具有免疫调节功能,可在自身免疫病、脓毒症等模型中调节免疫反应,但其在疟疾感染过程中的免疫调控机制尚不明确。
单细胞转录组技术的应用
单细胞RNA测序可在单个细胞水平解析免疫细胞的异质性与动态变化,为揭示病原体-宿主-药物三者互作提供了有力工具。此前研究多集中于体外或单一组织,缺乏对多组织免疫景观的系统描绘。
研究思路
第一阶段:构建多组织免疫图谱,系统性筛选青蒿素的关键靶向细胞
建立了疟疾感染小鼠模型,并设置对照组、感染组与青蒿素治疗组。随后,他们从外周血、肝脏和脾脏这三个关键免疫器官中采集样本进行单细胞RNA测序。通过UMAP降维聚类、差异表达基因分析、对髓系和淋巴细胞进行更精细的亚群再聚类以及分析细胞亚群在不同组织和处理组间的动态比例变化,并结合免疫荧光染色进行验证,研究将目标聚焦于在感染中显著扩增且功能活跃的免疫细胞亚群上。
第二阶段:聚焦核心细胞亚群,深入解析青蒿素的免疫调节通路
通过细胞毒性模块评分和差异基因重叠分析,研究人员精准锁定CD8+GZMB+ T细胞为青蒿素调控的核心靶点,并利用流式细胞术、Western Blot、qPCR和ELISA等技术进一步验证。为阐明其内在机制,团队对单细胞数据进行了转录因子调控网络和基因集富集分析,发现JAK-STAT信号通路可能被青蒿素抑制,且通过检测肝脏CD8+GZMB+ T细胞中JAK2和STAT3的磷酸化水平及其下游靶基因表达得到验证。
研究发现
进一步聚焦细胞亚群发现,一类特定的 CD8+GZMB+ T细胞 是驱动病理损伤的关键。该亚群在感染后比例显著上升,并表现出极高的细胞毒性与炎症因子评分,与肝组织损伤密切相关。重要的是,青蒿素治疗能特异性降低该致病亚群在肝脏中的比例并抑制其细胞毒性功能,这为解释青蒿素缓解临床症状提供了直接的细胞学基础。
在机制层面,研究发现青蒿素并非直接杀伤该细胞,而是通过抑制JAK2-STAT3信号通路来调节其功能。证据显示,感染后CD8+GZMB+ T细胞中STAT3转录活性及其上游激酶JAK2的磷酸化水平显著升高,而青蒿素处理能有效逆转这一现象,并下调其下游的细胞毒性相关基因(如Gzmb)的表达。
此外,细胞互作分析表明,感染后肝脏内形成了以中性粒细胞、肥大细胞和单核/巨噬细胞通过TNF等信号与CD8+ T细胞进行活跃通讯的炎症网络,这可能是驱动JAK-STAT通路激活的微环境基础。青蒿素治疗同样能削弱这一过度活跃的细胞间通讯。
Figure 1
多组织单细胞图谱的构建
● fig1A: 实验设计流程图,清晰展示了感染、治疗和取样时间点。
●fig1B: UMAP图显示所有细胞被注释为11种主要类型,如T/NK细胞、单核/巨噬细胞、B细胞等。
● fig1C & 1D: UMAP图显示细胞按组织来源和实验分组(对照、模型、治疗)的分布,表明细胞首先按组织分离,肝脏对感染和治疗的反应最显著。
● fig1E: 桑基图展示了不同组织和分组中细胞类型的比例变化。例如,感染后肝脏中T/NK和单核/巨噬细胞比例增加,而青蒿素治疗使其部分恢复。
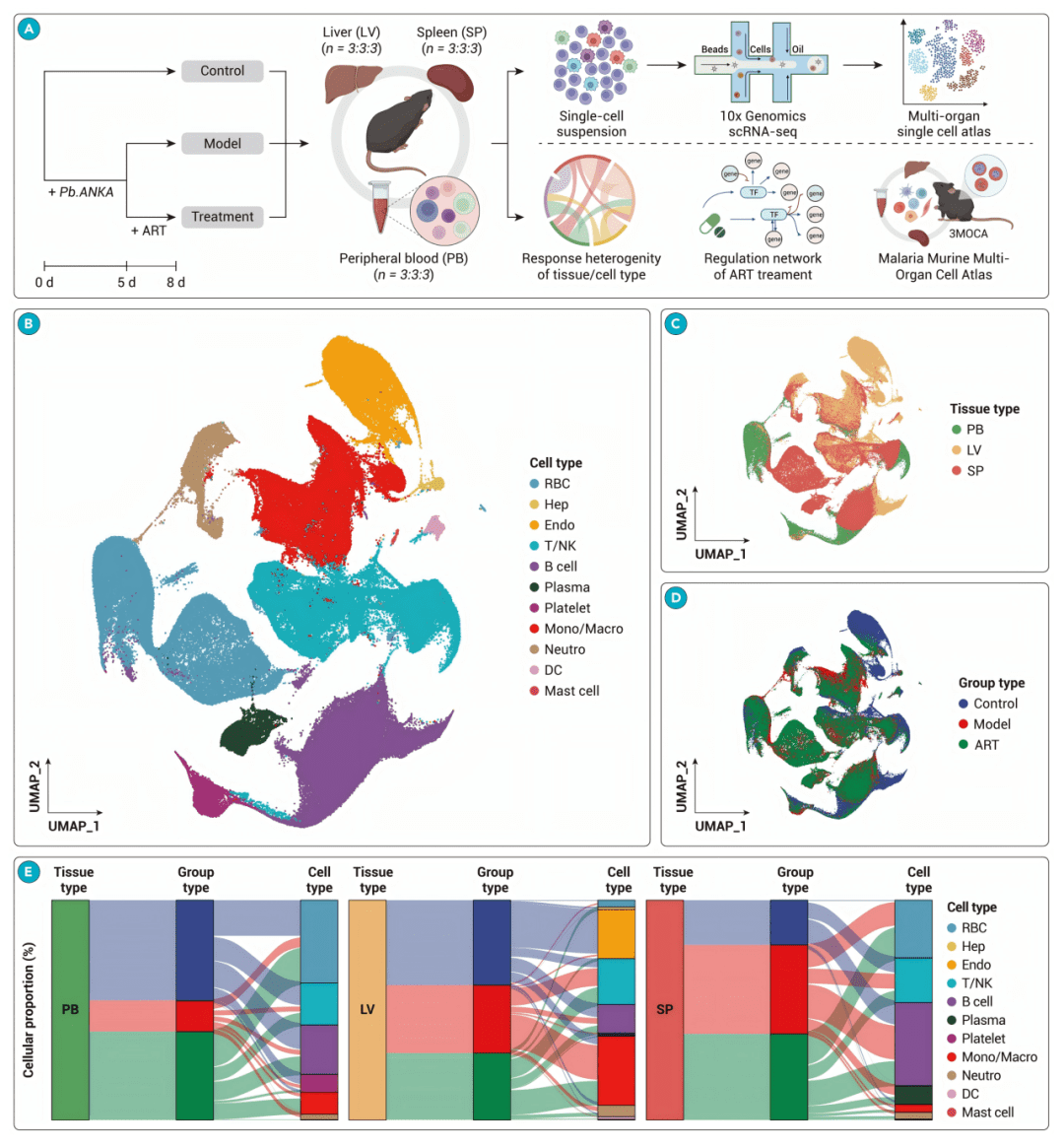
Figure 2
不同组织对感染的免疫反应特征
● fig2A: 雷达图显示,肝脏的T/NK和单核/巨噬细胞拥有最多的上调差异基因,表明肝脏是免疫应答的核心场所。
● fig2B & 2C: Upset图展示,肝脏拥有最多组织特异性的上调基因,凸显其反应的独特性。
● fig2D & 2E: 小提琴图显示,干扰素应答基因(如Ifitm1, Ifitm2)和细胞毒性基因(如Gzmb, Gzmk)在感染组普遍上调,且在肝脏中表达最高。
● fig2F: 点图显示,肝脏T/NK细胞富集于细胞因子受体等通路,而外周血和脾脏的富集通路不同,证明了功能上的组织特异性。
● fig2G: 热图证实,多种细胞因子/趋化因子在感染后主要富集于肝脏,而非外周血或脾脏。
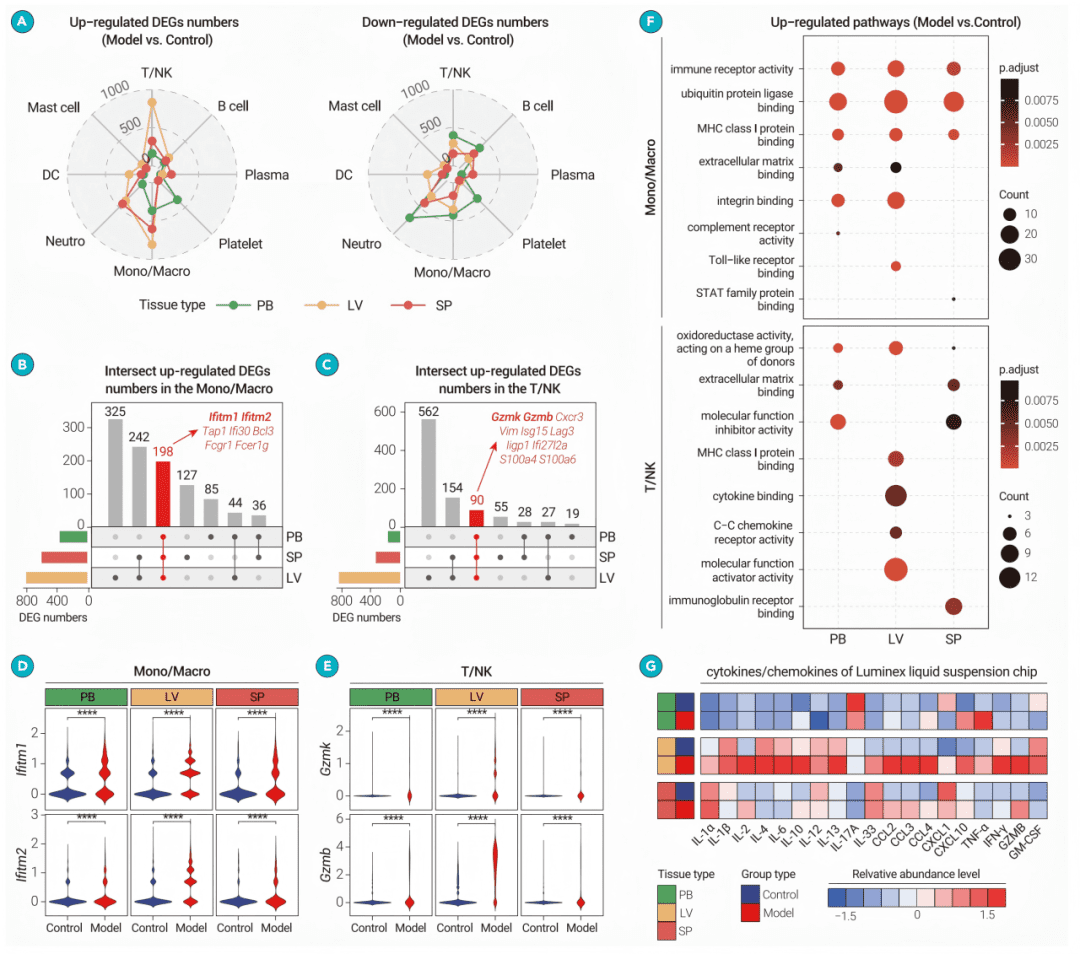
Figure 3
髓系细胞的异质性及动态变化
● fig3A & 3B: UMAP图和小提琴图展示了髓系细胞被分为6个主要类型和20个细分亚型,包括不同组织的巨噬细胞(如肝库弗细胞)和中性粒细胞亚群。
● fig3C: 气泡图显示了各髓系亚群在不同组织和分组中的比例动态。例如,表达Itgax的巨噬细胞亚群在感染后肝脏中显著增加。
● fig3D-G: 免疫荧光实验验证了scRNA-seq的发现,证实了例如肝脏中C1QA+ITGAX+和C1QA+CCR2+巨噬细胞亚群在感染后的比例变化。
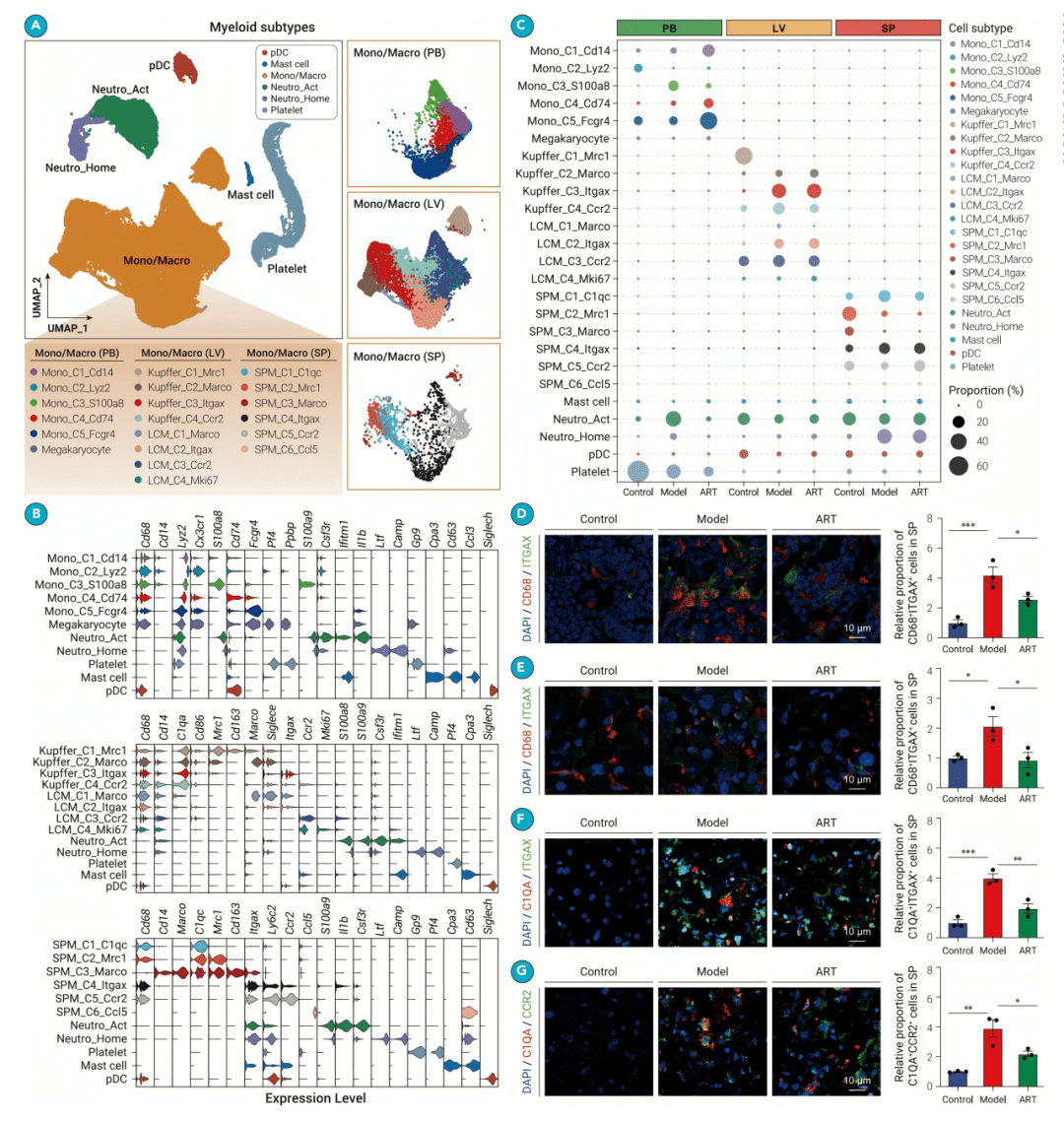
Figure 4
淋巴细胞亚群的异质性及动态变化
● fig4A & 4B: UMAP图和小提琴图将淋巴细胞分为23个亚群,包括细胞毒性CD8+ T细胞(Cd8_T_C2_Gzmb)、滤泡辅助性T细胞(Cd4_T_C3_Cxcr5)等。
● fig4C: 气泡图显示,细胞毒性CD8+ T细胞(Cd8_T_C2_Gzmb)和增殖性CD8+ T细胞(Cd8_T_C3_Mki67)在感染后显著扩增,并被青蒿素治疗抑制。
● fig4D-G: 免疫荧光实验定量验证了上述关键T细胞亚群(如肝脏中的CD8+GZMB+细胞)的比例变化,与测序结果高度一致。
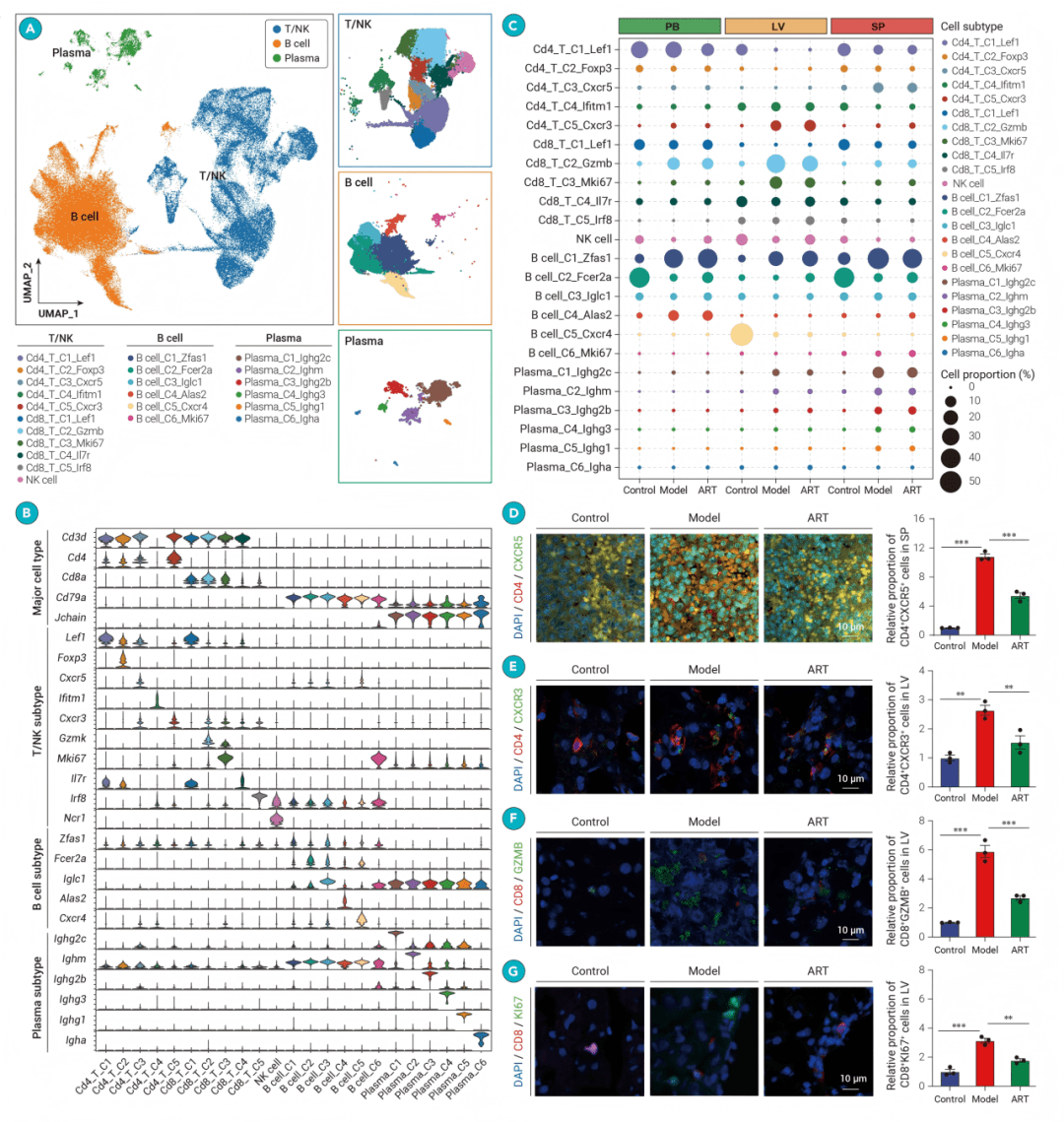
Figure 5
感染与治疗过程中的细胞间通讯网络
● fig5A: 热图显示,感染后多个细胞类型间的互作强度增强(如肝脏中T/NK细胞与其他细胞的交流),而青蒿素治疗削弱了这些互作。
● fig5B & 5C: 气泡图和Upset图表明,肝脏拥有最复杂的细胞互作网络,且TNF、CXCL等炎症信号通路在感染后特异性上调。
● fig5D & 5E: 弦图和小提琴图具体展示了*Tnf-Tnfrsf1b*等配体-受体对的互作强度及基因表达,指出中性粒细胞、肥大细胞等是激活T/NK细胞的关键“发送者”。
● fig5F & 5G: 免疫组化和免疫荧光实验证实,感染后肝脏中抗原提呈(MHC-I)增强,且巨噬细胞(F4/80+)与CD8+ T细胞发生共定位。
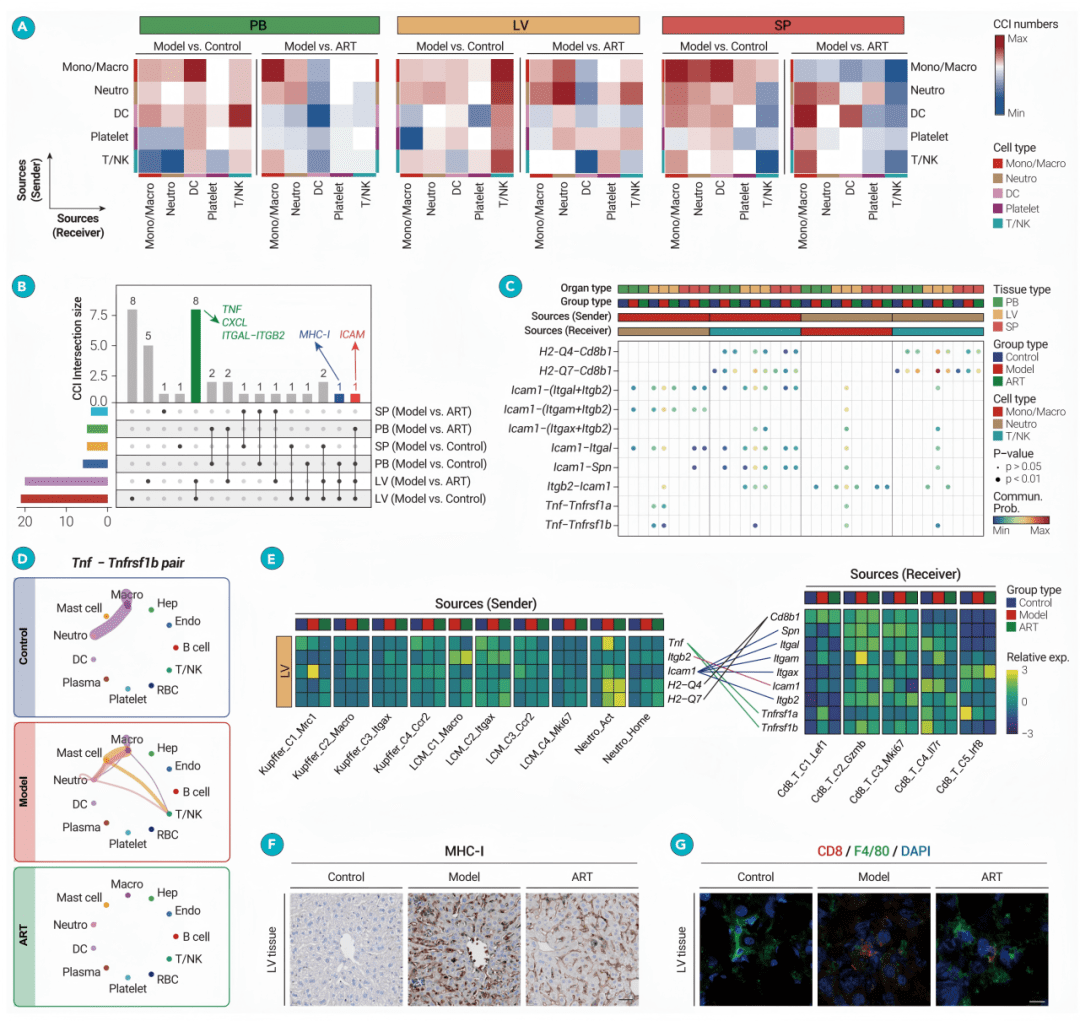
Figure 6
青蒿素对CD8+GZMB+ T细胞的免疫调节作用
● fig6A-C: 气泡图和小提琴图证明,CD8+GZMB+ T细胞在感染后拥有最多的差异基因,且其细胞毒性和细胞因子评分最高。
● fig6D & 6E: 数据显示,该细胞的毒性评分及相关基因在感染组中最高,且被青蒿素治疗显著降低。
● fig6F & 6G: 伪时序轨迹分析显示,青蒿素将细胞状态从“增殖激活”分支(Branch 1)导向“免疫调节”分支(Branch 2)。
● fig6H-M: 通过流式细胞术、WB、qPCR等实验验证,青蒿素在体内外均能特异性降低该细胞的比例,并抑制其产生IFN-γ和GZMB,且此效应在肝脏中最明显。
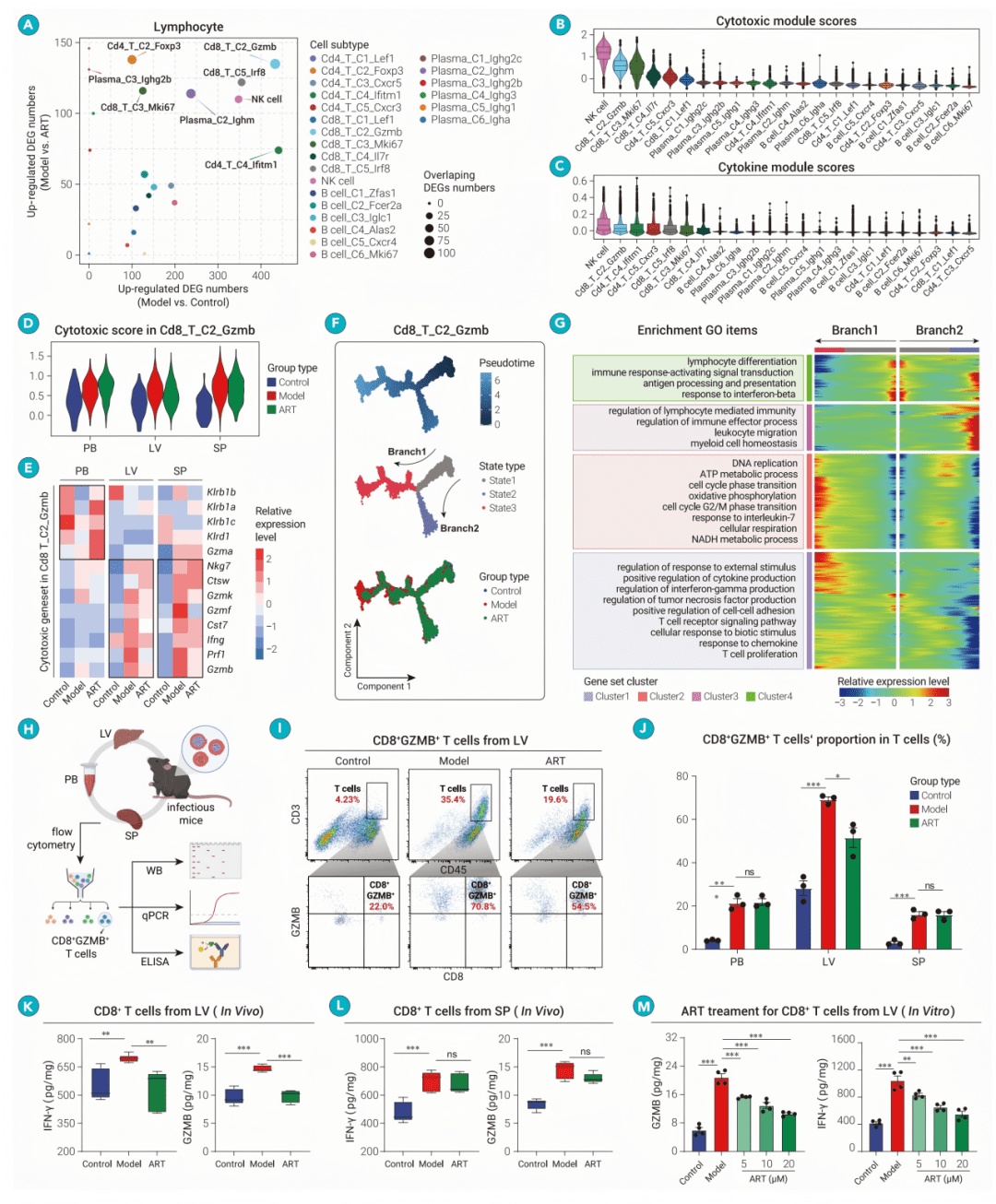
Figure 7
青蒿素通过JAK2-STAT3通路调控CD8+GZMB+ T细胞
● fig7A & 7B: 网络图和热图显示,转录因子STAT3的调控活性在感染后的CD8+GZMB+ T细胞中显著升高,并被青蒿素抑制。
● fig7C: 基因集富集分析图直接证实,青蒿素治疗显著下调了该细胞内的JAK-STAT信号通路。
● fig7D & 7G: Western Blot结果证明,感染后细胞中JAK2和STAT3的磷酸化水平(即激活形式)显著升高,而青蒿素处理能有效降低其磷酸化水平,但不影响总蛋白量。
● fig7E & 7F: 热图和条形图显示,STAT3下游靶基因(如Gzmb, Prdm1)的表达变化与磷酸化水平一致,完整勾勒出“青蒿素—抑制JAK2/STAT3磷酸化—下调毒性基因—减弱细胞功能”的分子通路。
Chen, Jiayun et al. “Single-cell profiling reveals immunoregulation of artemisinin on CD8+GZMB+ T cells via JAK2-STAT3 in malaria-infected mice.” Innovation (Cambridge (Mass.)) vol. 6,9 101080. 14 Aug. 2025, doi:10.1016/j.xinn.2025.101080
