RXBio Translates Sequence to Science and Industry
Tel: 027-87050299Email: sales@rxbio.cc
RXBio Translates Sequence to Science and Industry
1958年,克里克提出“中心法则”,概述了DNA、RNA和蛋白质间的信息传递。基因通过转录成前体RNA,经过可变剪接形成不同转录本,翻译成具有不同功能的蛋白质异构体。选择性剪接允许一个基因产生多种蛋白质异构体,实现特异性表达。《Nature Reviews Drug Discovery》近期讨论了蛋白质异构体在药物发现中的重要性,并建议利用这些异构体提高药物特异性和效果。因此,研究前体RNA的选择性剪接调节机制对于开发基于蛋白质异构体的治疗方法至关重要。RNA修饰是细胞生物学的关键调节因子,影响RNA的生成、转运、功能和代谢。主要的RNA修饰包括m6A、m6Am、m1A、m5C、ac4C、m7G、Ψ和A-to-I编辑,这些修饰由特定的RNA修饰酶添加、去除、识别和编辑,进而调控细胞功能。
二代NGS技术中,短读长RNA-seq广泛用于分析基因表达和可变剪接,常结合polyA富集或rRNA剔除。PAS-seq专注于定位mRNA的多聚腺苷酸化位点,而PolyA-seq分析polyA尾部长度变化,对理解mRNA稳定性和细胞命运重要。RNA修饰研究也关键,影响RNA稳定性和功能。多种方法如IP捕获和化学转化被开发来揭示RNA修饰多样性。为全面研究基因表达和修饰,需综合使用多种NGS技术。Oxford Nanopore的第三代测序平台能直接测序天然RNA链,其ONT-Direct RNA Sequencing(DRS)技术无需合成第二cDNA链和PCR扩增,避免引入错误,直接获取mRNA序列,并保留RNA碱基修饰信息,准确估算poly(A)尾长度,揭示RNA真实特征。
✔ 完善基因注释:发现新的转录本和基因,获得全面的转录组图谱。
✔ 差异分析:差异表达基因(DEG)、差异表达转录本(DET)、差异使用转录本(DTU)。
✔ 基因结构分析:准确分析可变剪接(AS)、多聚腺苷酸化位点(APA),3’UTR长度,polyA尾长。
✔ RNA修饰分析:m6A、m1A、m5C、m7G、hm5C、Ψ等。
✔ 转录本分辩率:在转录本水平上解析基因表达的调控机制及其功能。
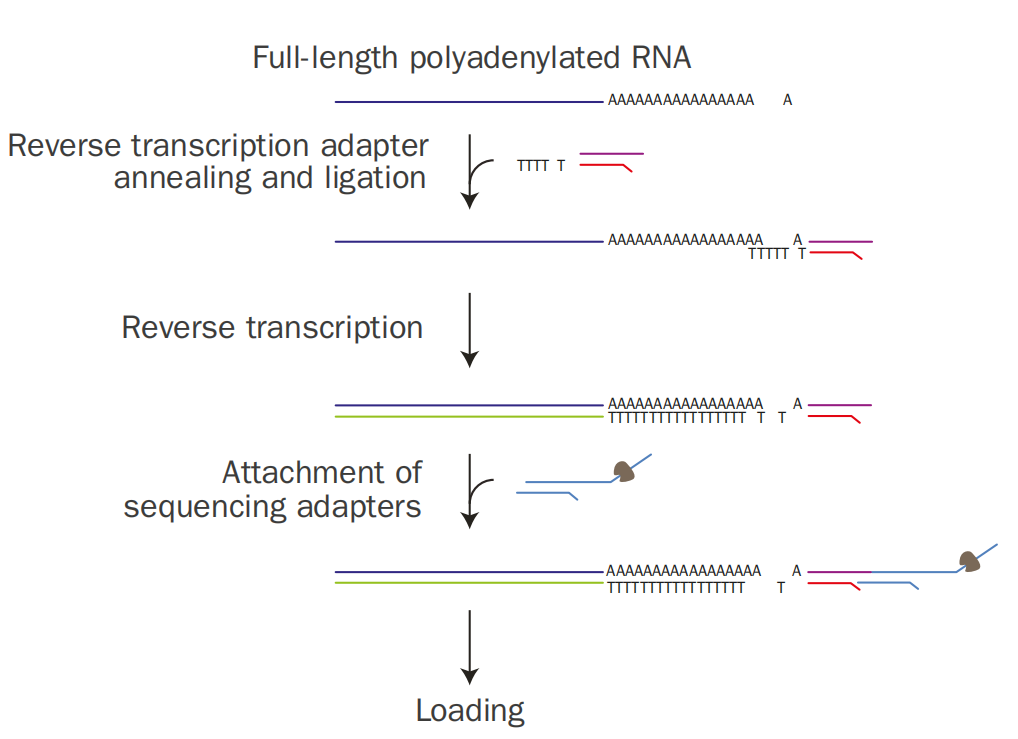
首先,带有oligo(dT)末端的引物与mRNA的PolyA尾巴退火连接,反转录形成RNA-DNA杂合链,添加连有分子马达的测序接头用于后续测序。


哈佛大学医学院/波士顿儿童医院陈开富课题组与西北大学曹圻课题组在《Molecular Cell》期刊在线发表题为“2′-O-methylation at internal sites on mRNA promotes mRNA stability”的研究论文。大量研究表明,稳定的mRNA对于研发RNA疫苗和RNA治疗非常重要。在本文报道的最新研究中,曹圻等人对Nm修饰的mRNA稳定性的影响进行了系统分析,结果显示Nm修饰的mRNA相较于未修饰的mRNA展现出更高的稳定性。与对照组相比,FBL蛋白结合的mRNA也呈现出增强的稳定性。当FBL表达被抑制后,无论是Nm修饰的mRNA还是通常与FBL结合的mRNA,其稳定性和RNA水平均显著下降,表明FBL催化的mRNA Nm修饰能有效提升mRNA稳定性,从而提高转录水平。
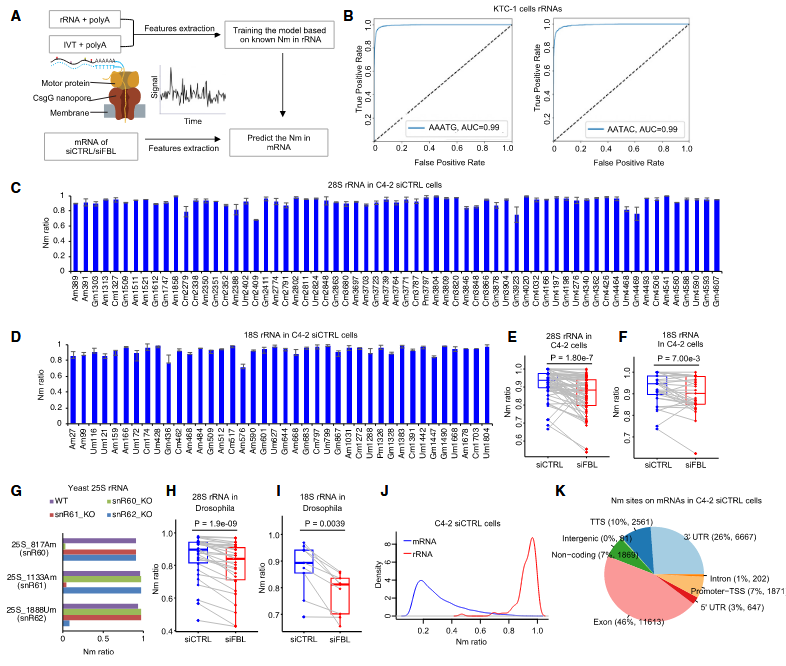
本研究中,作者创新性地融合了纳米孔直接RNA测序技术与机器学习算法,开发出一种名为NanoNm的新技术,旨在识别Nm修饰。该技术的实用性已在人类、酵母及果蝇的核糖体RNA样本中得到证实。通过应用NanoNm技术,研究者观察到FBL基因敲低与肿瘤相关mRNA中Nm修饰水平的下降现象,从而揭示了mRNA中Nm修饰的普遍性。进一步的分析表明,在前列腺癌的关键驱动基因PSMD13的mRNA中,Nm修饰的存在与更高的稳定性相关联。这一发现揭示了FBL基因在转录后水平通过催化癌基因mRNA的Nm修饰,增强其稳定性,进而促进前列腺癌的恶性进展。
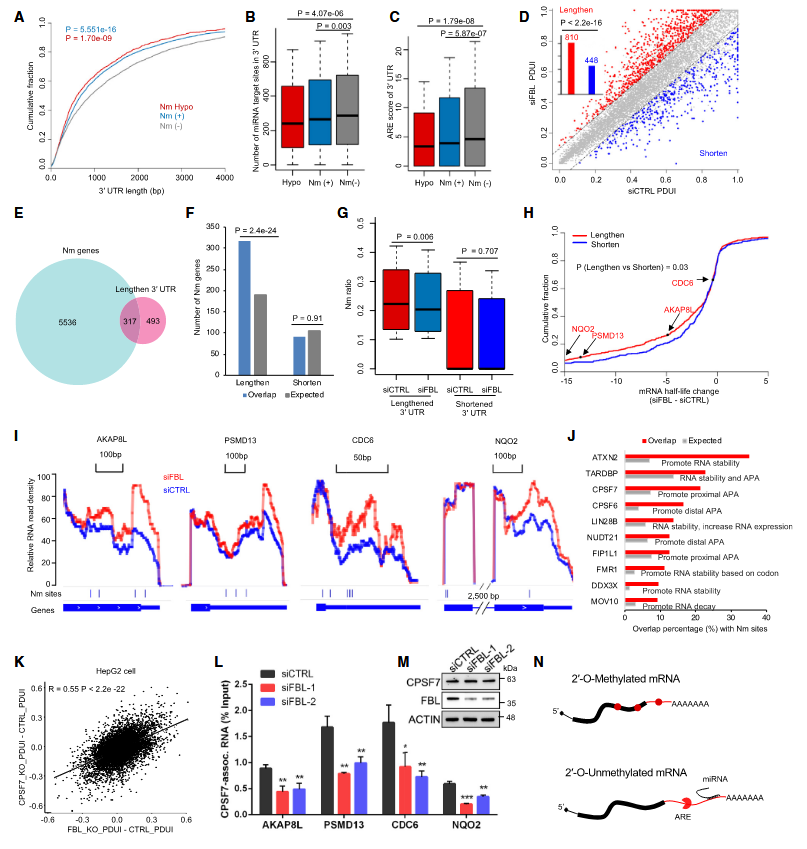
在机制研究领域,本研究揭示了Nm修饰的基因倾向于拥有较短的3’非翻译区(3’UTR),并且FBL的下调会显著影响3’UTR的长度。这一发现暗示FBL介导的Nm修饰可能通过调节3’UTR的可变性来增强mRNA的稳定性。基于此,本研究推测RNA结合蛋白可能通过识别Nm修饰的mRNA并与其发生相互作用,参与调控可变多聚腺苷酸化(APA)过程。通过整合CLIPdb RNA结合蛋白公共数据库的分析,研究结果表明,诸如ATX2、CPSF7等蛋白的结合位点与Nm修饰位点存在高度重叠,这暗示了这些蛋白可能负责识别并结合Nm修饰的mRNA。同时,本研究发现RNA结合蛋白,例如已知参与RNA稳定性或调控APA过程的CPSF7,可能通过特异性识别Nm修饰来影响mRNA的稳定性。在同时敲除FBL与CPSF7的情况下,观察到对APA模式的影响与单独敲除FBL时相一致,这表明CPSF7确实能够识别Nm修饰,并在Nm修饰介导的RNA稳定性调控中发挥关键作用。
参考文献
【1】 Kjer-Hansen, P., Phan, T.G. & Weatheritt, R.J. Protein isoform-centric therapeutics: expanding targets and increasing specificity. Nat Rev Drug Discov (2024).
【2】Li Y, Yi Y, Gao X, et al. 2′-O-methylation at internal sites on mRNA promotes mRNA stability. Molecular Cell. 2024 Jun;84(12):2320-2336.e6.

电话:027-870502099
邮箱:sales@rxbio.cc
地址:武汉市东湖高新区高新二路388 号
光谷生物医药加速器 18 栋 1-2层
单细胞多组学 空间转录组
三代测序 功能基因组
表观遗传学 互作组学
单细胞大数据 数据深度挖掘

欢迎关注公众号「瑞兴生物」